题目内容
【题目】下列有关乙酸性质的叙述错误的是
A. 乙酸是有强烈刺激性气味的无色液体,易溶于水和乙醇
B. 冰醋酸是纯净物
C. 乙酸的酸性比碳酸强,它是一元酸,能与碳酸盐反应
D. 发生酯化反应时,乙酸羧基中的氢原子跟醇中的羟基结合成水
【答案】D
【解析】A、乙酸是有强烈刺激性气味的无色液体,易溶于水和乙醇,故A正确;B、冰醋酸是纯净的醋酸,是纯净物,故B正确;C、乙酸含有一个羧基属于一元酸,能与碳酸盐反应制出碳酸,酸性强于碳酸,故C正确;D、发生酯化反应时乙酸分子脱羟基,故D错误;故选D。

 三新快车金牌周周练系列答案
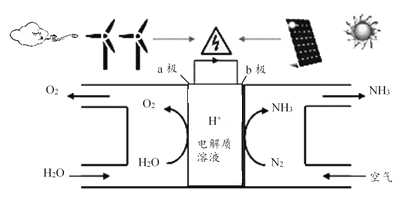
三新快车金牌周周练系列答案【题目】X、Y、Z、M、R、Q是短周期主族元素,部分信息如下表:
X | Y | Z | M | R | Q | |
原子半径/nm | 0.099 | 0.186 | 0.074 | 0.143 | ||
主要化合价 | +4,-4 | -2 | -1,+7 | +3 | ||
其他 | 常温下为黄色固体 | 无机非金属材料的主角 | 颜色反应为黄色 | 其氧化物可做耐火材料 |
(1)Q在元素周期表中的位置是______.
(2)Y与R相比,非金属性较强的是________(用元素符号表示),下列事实能证明这一结论的是______(填字母序号)
a.常温下Y的单质呈固态,R的单质呈气态
b.稳定性:HR>YH4
c.Y与R形成的化的中Y呈正价
(3)根据表中数据推测,Y的原子半径的最小范围是______.
(4)甲、乙是上述某些元素的最高价氧化物对应的水化物,且甲+乙→丙+水.若丙的水溶液呈碱性,则丙的化学式是______.
(5)已知1mo1XM2(g)被氧化为1mo1XM3(g)的△H=﹣99kJ/mo1.写出由XM2生成XM3的热化学反应方程式 ________。
【题目】如图利用培养皿探究氨气的性质。实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面。下表中对实验现象所做的解释正确的是

选项 | 实验现象 | 解释 |
A | 浓盐酸附近产生白烟 | NH3与浓盐酸反应生成了NH4Cl固体 |
B | 浓硫酸附近无明显现象 | NH3与浓硫酸不发生反应 |
C | 氯化物溶液变浑浊 | 该溶液一定是AlCl3溶液 |
D | 干燥的红色石蕊试纸不变色,湿润的红色石蕊试纸变蓝 | NH3是一种可溶性碱 |
A. AB. BC. CD. D
【题目】氯化铁可用作金属蚀刻、有机合成的催化剂,研究其制备及性质是一个重要的课题。
(1)氯化铁晶体的制备(夹持及加热装置省略):

①实验过程中装置丙中可能发生反应的离子方程式有____________。
②该装置气密性检查方法及操作:_________________________。
(2)氯化铁的性质探究:
为探究氯化铁的性质设计了如下实验。(查阅文献知:①氯化铁的熔点为306℃、沸点为315℃,易升华,气态FeCl3会分解成FeCl2和Cl2 ②FeCl2熔点670℃)
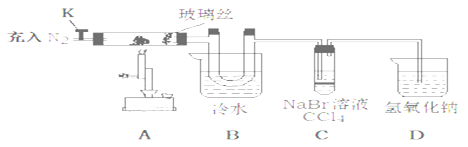
操作步骤 | 实验现象 | 解释原因 |
打开K,充入氮气 | D中有气泡产生 | ①充入N2的原因___________。 |
关闭K,加热至600℃,充分灼烧固体 | B中出现棕黄色固体 | ②产生现象的原因__________________________。 |
实验结束,振荡C静置 | ③_____________ | ④________________________。(用方程式解释) |