题目内容
【题目】某研究性学习小组请你参与“研究铁与水反应所得固体物质的成分、性质及再利用”实验探究,并共同解答下列问题:
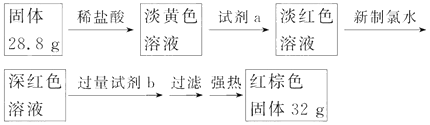
图1 图2
(1)探究一:设计如图1所示装置进行“铁与水反应”的实验.
a.硬质玻璃管B中发生反应的化学方程式为 .
b.反应前A中投放碎瓷片的目的是 .
c.装置E中的现象是 .
(2)探究二:设计如下实验方案确定反应后硬质玻璃管B中黑色固体的成分.
a.待硬质玻璃管B冷却后,取少许其中的固体物质溶于后,将所得溶液分成两份.
b.一份滴加几滴KSCN溶液.若溶液变血红色,推断硬质玻璃管B中固体物质的成分为(选填序号,下同);若溶液未变血红色,推断硬质玻璃管B中固体物质的成分为 .
①一定有Fe3O4 ②一定有Fe ③只有Fe3O4 ④只有Fe
c.另一份用(填仪器名称)加入 , 可以证明溶液中存在Fe2+ .
(3)探究三:设计如下流程(如图2)测定反应后硬质玻璃管B中固体含铁元素的质量分数.
a.试剂b的化学式是 .
b.计算反应后B装置中铁元素的质量分数为 .
【答案】
(1)3Fe+4H2O(g) ![]() Fe3O4+4H2;防止暴沸;黑色固体变红,右端管壁有水珠
Fe3O4+4H2;防止暴沸;黑色固体变红,右端管壁有水珠
(2)稀硫酸;①;②;胶头滴管;酸性KMnO4溶液溶液褪色
(3)NaOH;77.8%
【解析】解:【探究一】a.硬质管中铁与水蒸气在高温下反应生成四氧化三铁和氢气,反应的化学方程式为:3Fe+4H2O(g) ![]() Fe3O4+4H2 , 所以答案是:3Fe+4H2O(g)
Fe3O4+4H2 , 所以答案是:3Fe+4H2O(g) ![]() Fe3O4+4H2;b.液体加热时容易发生暴沸现象,加入碎瓷片的作用是防止暴沸,所以答案是:防止暴沸;c.装置E中发生反应为:H2+CuO
Fe3O4+4H2;b.液体加热时容易发生暴沸现象,加入碎瓷片的作用是防止暴沸,所以答案是:防止暴沸;c.装置E中发生反应为:H2+CuO ![]() Cu+H2O,则反应现象是:黑色固体变红,右端管壁有水珠,所以答案是:黑色固体变红,右端管壁有水珠;【探究二】在验证反应后黑色固体的成分时,检验Fe3+ , 最佳试剂为KSCN溶液;在确定存在Fe3+时,检验Fe2+ , 可用酸性KMnO4溶液.由于酸性KMnO4溶液与盐酸发生反应,所以在溶解反应后的黑色固体时,不能用盐酸,也不能用硝酸(因为HNO3可氧化Fe2+),可用稀硫酸,
Cu+H2O,则反应现象是:黑色固体变红,右端管壁有水珠,所以答案是:黑色固体变红,右端管壁有水珠;【探究二】在验证反应后黑色固体的成分时,检验Fe3+ , 最佳试剂为KSCN溶液;在确定存在Fe3+时,检验Fe2+ , 可用酸性KMnO4溶液.由于酸性KMnO4溶液与盐酸发生反应,所以在溶解反应后的黑色固体时,不能用盐酸,也不能用硝酸(因为HNO3可氧化Fe2+),可用稀硫酸,
a.根据分析可知,溶解反应后固体需要用稀硫酸,
所以答案是:稀硫酸;
b.一份滴加几滴KSCN溶液,若溶液变血红色,说明溶液中含有铁离子,则可推断硬质玻璃管B中固体物质的成分为:①一定有Fe3O4;
若溶液未变血红色,则溶液中不存在铁离子,可推断硬质玻璃管B中固体物质中一定存在Fe,即②正确,所以答案是:①;②;c.检验亚铁离子,需要用胶头滴管加入酸性高锰酸钾溶液,若酸性高锰酸钾溶液褪色,则证明溶液中含有亚铁离子,所以答案是:胶头滴管;酸性KMnO4溶液,溶液褪色;【探究三】a.由“红棕色固体”知,该物质为Fe2O3 , 则FeCl3 ![]() Fe(OH)3和NaCl,过滤后加强热生成红棕色固体,则试剂b为NaOH溶液,所以答案是:NaOH;b.氧化铁的质量为:m(Fe2O3)=32g,则氧化铁的物质的量为:n(Fe2O3)=
Fe(OH)3和NaCl,过滤后加强热生成红棕色固体,则试剂b为NaOH溶液,所以答案是:NaOH;b.氧化铁的质量为:m(Fe2O3)=32g,则氧化铁的物质的量为:n(Fe2O3)= ![]() =0.2mol,则含有铁元素的物质的量为:n(Fe)=0.4mol,则反应后B装置中铁元素的质量分数为:
=0.2mol,则含有铁元素的物质的量为:n(Fe)=0.4mol,则反应后B装置中铁元素的质量分数为: ![]() ×100%≈77.8%,所以答案是:77.8%.
×100%≈77.8%,所以答案是:77.8%.

 53随堂测系列答案
53随堂测系列答案【题目】右下图中P是可自由平行滑动的活塞。在相同温度时,向A容器中充入2 mol SO3(g),关闭K,向B容器中充入1 mol SO3(g),两容器分别发生反应:2SO3(g) ![]() 2SO2(g)+O2(g)。已知起始时容器A和B的体积均为a L。试回答:
2SO2(g)+O2(g)。已知起始时容器A和B的体积均为a L。试回答:
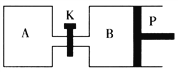
(1)反应达到平衡时容器B的体积变为1.2aL,容器B中SO3转化率为___________。
(2)若打开K,一段时间后重新达到平衡,容器B的体积为___________L(连通管中气体体积忽略不计)。
(3)将不同物质的量的H2O(g)和 CO分别通入体积为2L的恒容密闭容器中,发生反应:H2O(g)+CO(g)![]() CO2(g)+H2(g) △H,得到如下数据:
CO2(g)+H2(g) △H,得到如下数据:
实验 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | CO | H2 | |||
Ⅰ | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
Ⅱ | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
Ⅲ | 900 | 2 | 1 | a | b | t |
①由表中数据可知该反应的△H_______ 0(填“>”或“<”)。
②实验Ⅲ中a=______,达平衡时实验Ⅱ和实验Ⅲ中H2O(g)的转化率的大小关系为:α2(H2O)____α3(H2O)(填“>”、“<”或“=”)。
