题目内容
【题目】图中A~K分别代表一种物质.已知A易溶于水,分解得到B、C、D的物质的量比为1:1:2,B气体能使品红溶液褪色,C为常见的液体,D气体能使湿润的紫色石蕊试纸变蓝,F为淡黄色固体单质,K为常见的二元强酸,图中有部分生成物未标出.
(1)A的化学式为 .
(2)写出反应①的离子方程式: .
(3)写出反应②、④、⑤的化学方程式:②;
④;
⑤ .
(4)在反应③中,每生成标准状况下2.24L G时,转移电子的物质的量为mol.
【答案】
(1)(NH4)2SO3
(2)NH ![]() +OH﹣
+OH﹣ ![]() NH3↑+H2O
NH3↑+H2O
(3)2Mg+SO2 ![]() 2MgO+S;4NH3+5O2
2MgO+S;4NH3+5O2 ![]() 4NO+6H2O;S+6HNO3(浓)
4NO+6H2O;S+6HNO3(浓) ![]() 6NO2↑+H2SO4+2H2O
6NO2↑+H2SO4+2H2O
(4)0.2
【解析】解:已知A易溶于水,分解得到B、C、D的物质的量比为1:1:2,D气体能使湿润的紫色石蕊试纸变蓝,A能与氢氧化钠反应达到D,则D为NH3 , A为铵盐,而B气体能使品红溶液褪色,C为常见的液体,则B为SO2 , C为H2O,可知A为(NH4)2SO3 . 过氧化钠与水反应生成G,G能与氨气反应生成H,H与G进一步反应生成I,则G为O2 , H为NO,I为NO2 , B与Mg反应生成淡黄色固体单质F,则F为S、E为MgO,硫与J反应生成K、水、NO2 , 且K为常见的二元强酸,则H为HNO3 , K为H2SO4 . (1)A的化学式为:(NH4)2SO3 , 所以答案是:(NH4)2SO3;(2)反应①的离子方程式:NH4++OH﹣ ![]() NH3↑+H2O,所以答案是:NH
NH3↑+H2O,所以答案是:NH ![]() +OH﹣
+OH﹣ ![]() NH3↑+H2O;(3)反应②的方程式为:2Mg+SO2
NH3↑+H2O;(3)反应②的方程式为:2Mg+SO2 ![]() 2MgO+S,反应④的方程式为:4NH3+5O2
2MgO+S,反应④的方程式为:4NH3+5O2 ![]() 4NO+6H2O,反应⑤的方程式为:S+6HNO3(浓)
4NO+6H2O,反应⑤的方程式为:S+6HNO3(浓) ![]() 6NO2↑+H2SO4+2H2O,所以答案是:2Mg+SO2
6NO2↑+H2SO4+2H2O,所以答案是:2Mg+SO2 ![]() 2MgO+S;4NH3+5O2
2MgO+S;4NH3+5O2 ![]() 4NO+6H2O;S+6HNO3(浓)
4NO+6H2O;S+6HNO3(浓) ![]() 6NO2↑+H2SO4+2H2O;(4)在反应③为2Na2O2+2H2O=4NaOH+O2↑,反应中过氧化钠起氧化剂、还原剂作用,每生成标准状况下2.24L O2时,转移电子的物质的量为
6NO2↑+H2SO4+2H2O;(4)在反应③为2Na2O2+2H2O=4NaOH+O2↑,反应中过氧化钠起氧化剂、还原剂作用,每生成标准状况下2.24L O2时,转移电子的物质的量为 ![]() ×2=0.2 mol,所以答案是:0.2.
×2=0.2 mol,所以答案是:0.2.

【题目】有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的:
阳离子 | K+、Na+ 、Cu2+、 Al3+ |
阴离子 | SO |
为了鉴别上述化合物,分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,仅有B为紫色(透过蓝色钴玻璃);
④在各溶液中加入硝酸酸化的硝酸钡溶液,只有A中放出无色气体,只有D中产生白色沉淀;
⑤将B、C两溶液混合,未见沉淀或气体生成.根据上述实验填空:
(1)写出B、D的化学式:B , D .
(2)C可用作净水剂,用离子方程式表示其净水原理 .
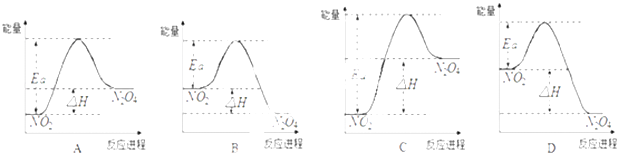
(3)将含0.01mol A的溶液与含0.02mol E的溶液反应后,向溶液中滴加0.1molL﹣1稀盐酸.下列图象能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是
(4)在mmL b molL﹣1 C溶液中,加入等体积a molL﹣1 的E溶液.当a≤3b时,生成沉淀的物质的量是 mol;当3b<a<4b件时,生成沉淀的物质的量是 mol.