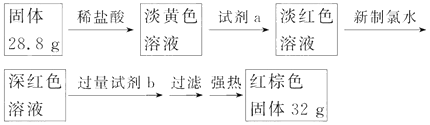
题目内容
【题目】右下图中P是可自由平行滑动的活塞。在相同温度时,向A容器中充入2 mol SO3(g),关闭K,向B容器中充入1 mol SO3(g),两容器分别发生反应:2SO3(g) ![]() 2SO2(g)+O2(g)。已知起始时容器A和B的体积均为a L。试回答:
2SO2(g)+O2(g)。已知起始时容器A和B的体积均为a L。试回答:
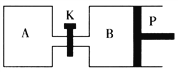
(1)反应达到平衡时容器B的体积变为1.2aL,容器B中SO3转化率为___________。
(2)若打开K,一段时间后重新达到平衡,容器B的体积为___________L(连通管中气体体积忽略不计)。
(3)将不同物质的量的H2O(g)和 CO分别通入体积为2L的恒容密闭容器中,发生反应:H2O(g)+CO(g)![]() CO2(g)+H2(g) △H,得到如下数据:
CO2(g)+H2(g) △H,得到如下数据:
实验 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | CO | H2 | |||
Ⅰ | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
Ⅱ | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
Ⅲ | 900 | 2 | 1 | a | b | t |
①由表中数据可知该反应的△H_______ 0(填“>”或“<”)。
②实验Ⅲ中a=______,达平衡时实验Ⅱ和实验Ⅲ中H2O(g)的转化率的大小关系为:α2(H2O)____α3(H2O)(填“>”、“<”或“=”)。
【答案】 40% 2.6a < 0.6 >
【解析】(1) 2SO3(g) ![]() 2SO2(g)+O2(g)
2SO2(g)+O2(g)
起始量(mol) 2 0 0
改变量(mol)2x 2x x
平衡量(mol)2-2x 2x x
根据阿伏加德罗定律的推论:同温同压条件下,物质的量之比等于体积之比,有: ![]() =
=![]() ,解得x=0.4,所以转化率为40%;(2)若打开K,A和B就成了一个容器,因此再次达到平衡的总体积应该为3×1.2aL=3.6aL,减去A中原来的1L,B的体积就应该是2.6aL;(3)①对比实验Ⅰ与实验Ⅱ数据可知,温度升高,CO的转化率减小,所以正反应为放热反应,故△H<0;②根据表中反应Ⅱ的数据,CO、H2O的转化量为0.4mol,则反应Ⅲ的转化量也是0.4mol,所以平衡时a=1mol-0.4mol=0.6mol;实验Ⅱ中H2O的初始量为1mol、CO的初始量为2mol,实验Ⅲ中H2O的初始量为2mol、CO的初始量为1mol,所以实验ⅡH2O的转化率大于实验Ⅲ,α2(H2O)>α3(H2O)。
,解得x=0.4,所以转化率为40%;(2)若打开K,A和B就成了一个容器,因此再次达到平衡的总体积应该为3×1.2aL=3.6aL,减去A中原来的1L,B的体积就应该是2.6aL;(3)①对比实验Ⅰ与实验Ⅱ数据可知,温度升高,CO的转化率减小,所以正反应为放热反应,故△H<0;②根据表中反应Ⅱ的数据,CO、H2O的转化量为0.4mol,则反应Ⅲ的转化量也是0.4mol,所以平衡时a=1mol-0.4mol=0.6mol;实验Ⅱ中H2O的初始量为1mol、CO的初始量为2mol,实验Ⅲ中H2O的初始量为2mol、CO的初始量为1mol,所以实验ⅡH2O的转化率大于实验Ⅲ,α2(H2O)>α3(H2O)。

【题目】硼元素在自然界主要以硼酸.硼酸盐和硼硅酸盐存在.请回答下列问题: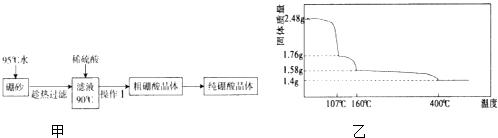
(1)硼元素是ⅢA族的第一个元素,原子结构示意图为 , 天然硼元素有两种稳定同位素10B、11B,其相对原子质量分别为10和11,它们的相对丰度分别为20%和80%,硼元素的平均相对质量为 .
(2)硼酸(H3BO3)是一元弱酸,工业上用硼砂(Na2B4O710H2O)制备硼酸晶体的流程如图甲:
不同温度下硼酸的溶解度见下表:
温度/℃ | 0 | 20 | 40 | 60 | 80 |
溶解度/g | 2.7 | 5.0 | 8.7 | 14.8 | 23.8 |
①写出硼砂溶液和稀硫酸反应的离子方程式 .
②上述流程中获得粗硼酸晶体的操作Ⅰ为、过滤,进一步将粗硼酸晶体提纯的方法是 .
③25℃时0.1mol/L硼酸溶液的pH约为5.1,则其电离常数K约为 .
(3)硼酸在加热过程中发生分解的失重曲线如图乙所示.
①硼酸从开始加热到107℃时,发生反应的化学方程式为 .
②硼酸加热到160℃得到的固体的化学式为 . (B元素的相对原子质量按11计算)
(4)NaBH4由于H元素显﹣1价,具有强还原性,是有机化学上的万能还原剂.在碱性条件下电解NaBO2溶液可以制得NaBH4 , 其反应方程式为NaBO2+2H2O=2O2↑+NaBH4 , 则阴极反应式为 .