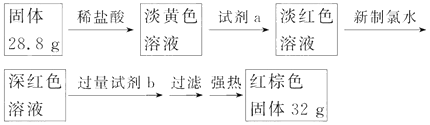
题目内容
【题目】下列叙述中,错误的是( )
A. 所有铵盐都易溶于水,不是所有铵盐中的氮均呈—3价
B. NH4Cl和NaCl的固体混合物可用升华法分离
C. 不是所有铵盐受热分解的产物中均有NH3
D. NH4Cl溶液中加入NaOH浓溶液共热,反应的离子方程式为 NH4++OH- ==NH3↑+H2O
【答案】B
【解析】硝酸铵中氮元素化合价为-3、+5价,故A正确;利用氯化铵加热易分解,NH4Cl和NaCl的固体混合物加热分离, 故B错误;硝酸铵分解不生成氨气,故C正确;NH4Cl溶液中加入NaOH浓溶液共热,反应的离子方程式为 NH4++OH- ==NH3↑+H2O,故正确。

 阅读快车系列答案
阅读快车系列答案【题目】某兴趣小组欲通过实验方法验证Fe2+的某些性质.
(1)在实验前,依据Fe2+的性,填写了如表.
实验操作 | 预期现象 | 反应的离子方程式 |
向盛有新割FeSO4溶液的试管中滴入数滴浓硝酸,振荡 | 试管中产生红棕色气体,溶液颜色逐渐变黄 | Fe2++NO3﹣+2H+=Fe3++NO2↑+H2O |
依照表中操作,该小组进行实验.观察到液面上方气体逐渐变为红棕色,但试管中溶液颜色却变为深棕色.
(2)分别取少量反应后的溶液于两只试管中,一只滴加几滴KSCN溶液,溶液变为变红,则溶液中含有;另一只试管滴加几滴溶液,产生蓝色沉淀,则含有Fe2+ .
(3)该小组讨论认为深棕色可能是NO2或NO与铁的某一种离子发生反应引起的.
提出猜想:
ⅰ.NO2与Fe2+发生反应ⅱ.NO2 与Fe3+发生反应
ⅲ.NO与Fe2+发生反应ⅳ.
(4)该小组用如图装置进行探究: 
步骤 | 操作及现象 | 解释或结论 |
① | 关闭k、b,打开a,开始甲中反应,一段时间后,观察到丙中溶液逐渐变为深棕色,而丁中溶液无明显变化 | 溶液深棕色由与NO或NO2反应而的得到 |
② | 停止甲中反应,打开k、b,关闭a,持续通入N2一段时间 | 该操作的目的 |
③ | 更换新的丙、丁装置,再通一段时间N2后关闭k,使甲中反应继续,观察到的现象与步骤①中相同 | 乙瓶中发生的化学反应方程式为 |
(5)结合实验猜想,得出结论:
溶液呈深棕色的原因:肯定成立的是猜想;不确定的是猜想 , 有待后续实验进一步探究.
【题目】硼元素在自然界主要以硼酸.硼酸盐和硼硅酸盐存在.请回答下列问题: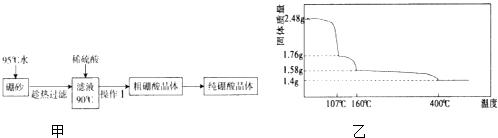
(1)硼元素是ⅢA族的第一个元素,原子结构示意图为 , 天然硼元素有两种稳定同位素10B、11B,其相对原子质量分别为10和11,它们的相对丰度分别为20%和80%,硼元素的平均相对质量为 .
(2)硼酸(H3BO3)是一元弱酸,工业上用硼砂(Na2B4O710H2O)制备硼酸晶体的流程如图甲:
不同温度下硼酸的溶解度见下表:
温度/℃ | 0 | 20 | 40 | 60 | 80 |
溶解度/g | 2.7 | 5.0 | 8.7 | 14.8 | 23.8 |
①写出硼砂溶液和稀硫酸反应的离子方程式 .
②上述流程中获得粗硼酸晶体的操作Ⅰ为、过滤,进一步将粗硼酸晶体提纯的方法是 .
③25℃时0.1mol/L硼酸溶液的pH约为5.1,则其电离常数K约为 .
(3)硼酸在加热过程中发生分解的失重曲线如图乙所示.
①硼酸从开始加热到107℃时,发生反应的化学方程式为 .
②硼酸加热到160℃得到的固体的化学式为 . (B元素的相对原子质量按11计算)
(4)NaBH4由于H元素显﹣1价,具有强还原性,是有机化学上的万能还原剂.在碱性条件下电解NaBO2溶液可以制得NaBH4 , 其反应方程式为NaBO2+2H2O=2O2↑+NaBH4 , 则阴极反应式为 .
【题目】请按下列要求填空:
(1)已知:99 ℃时,水的离子积常数Kw=1.0×10-12,该温度下测得0.1 mol·L-1 Na2A溶液的pH=6。
①H2A在水溶液中的电离方程式为_________________________。
②体积相等、pH=1的盐酸与H2A溶液分别与足量Zn反应,产生的氢气___(填编号)。
A.盐酸多 B.H2A多 C.一样多 D.无法确定
③将0.1 mol·L-1 H2A溶液与0.2 mol·L-1氨水等体积混合,完全反应后溶液中各离子浓度从大到小的顺序为__________________________________。
(2)已知:25 ℃时,电离平衡常数:
化学式 | CH3COOH | H2CO3 | HClO |
电离平 衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K=3.2×10-8 |
请回答下列问题:
①物质的量浓度为0.1 mol/L的下列四种物质:
a.Na2CO3 b.NaClO c.CH3COONa d.NaHCO3
pH由大到小的顺序是________________________________(填编号)。
②常温下0.1 mol/L的CH3COOH溶液加水稀释过程中,下列表达式的数据一定变大的是______(填编号)。
A.c(H+) B. ![]() C.c(H+)·c(OH-) D.
C.c(H+)·c(OH-) D.![]()
③写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:________。
④25 ℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)=_______(填准确数值)。
⑤25 ℃时,将a mol/L的醋酸与b mol/L氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离平衡常数为_______________。