题目内容
14.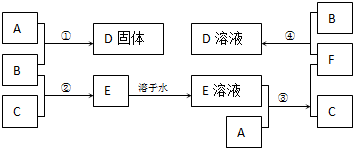 室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适的反应条件下,它们可以按下面的框图进行反应.又知E溶液是无色的.
室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适的反应条件下,它们可以按下面的框图进行反应.又知E溶液是无色的.请回答:
(1)写出A、B、C的化学式.
A:Fe B:Cl2 C:H2
(2)反应①的化学方程式为:2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3
(3)反应③的化学方程式为:Fe+2HCl=FeCl2+H2↑
(4)反应④的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-.
分析 单质B为黄绿色气体,可知B为Cl2,C为单质气体,B与C反应生成E,E溶液是无色的,则C为H2,E为HCl,A与盐酸生成氢气,A应为金属固体单质,A与盐酸反应后生成F为A的氯化物,F又能与氯气反应生成D,且A与氯气可以直接生成D,可推知A为Fe,根据转化关系可知,F为FeCl2,D为FeCl3,结合物质的相关性质解答该题;
解答 解:单质B为黄绿色气体,可知B为Cl2,C为单质气体,B与C反应生成E,E溶液是无色的,则C为H2,E为HCl,A与盐酸生成氢气,A应为金属固体单质,A与盐酸反应后生成F为A的氯化物,F又能与氯气反应生成D,且A与氯气可以直接生成D,可推知A为Fe,根据转化关系可知,F为FeCl2,D为FeCl3,
(1)由以上分析可知,A为Fe,B为Cl2,C为H2,
故答案为:Fe,Cl2,H2;
(2)反应①为Fe和Cl2的反应,反应的化学方程式为2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3,
故答案为:2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3;
(3)反应③为Fe和HCl的反应,反应的离子方程式为Fe+2HCl=FeCl2+H2↑,
故答案为:Fe+2HCl=FeCl2+H2↑;
(4)反应④为FeCl2和Cl2的反应,反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,
故答案为:2Fe2++Cl2=2Fe3++2Cl-.
点评 本题考查无机物的推断,难度不大,注意根据物质颜色与反应现象作为突破口进行推断,学习中注意元素化合物的性质及反应现象掌握.

练习册系列答案
 全能测控一本好卷系列答案
全能测控一本好卷系列答案
相关题目
5.已知723K时,2SO2(g)+O2(g)?2SO3(g)△H=-Q,在相同条件下,向一密闭容器中通入2mol SO2和1mol O2,达到平衡时放出的热量为Q1;向另一体积相同的密闭容器中通入1mol SO2和0.5mol O2,达到平衡时放出的热量为Q2.则Q1、Q2、Q满足的关系是( )

| A. | Q=2Q2 | B. | Q1=2Q2 | C. | Q=Q1>Q2 | D. | Q>Q1>Q2 |
2.银锌电池广泛用作各种电子仪器的电源,其电极分别为Ag2O、Zn,电解质溶液为KOH溶液,总反应为Ag2O+Zn+H2O═2Ag+Zn(OH)2.下列说法中错误的是( )
| A. | 工作时,负极上发生反应的物质是Zn | |
| B. | 溶液中OH-向正极移动,K+、H+向负极移动 | |
| C. | 工作时,负极区溶液氢氧根浓度减小 | |
| D. | 正极上发生的反应是Ag2O+H2O+2e-═2Ag+2OH- |
9.0.05mol某金属单质与足量的盐酸反应,放出1.12LH2(标准状况),并转变为具有Ne原子的电子层结构的离子,该金属元素在元素周期表中的位置是( )
| A. | 第三周期第IA族 | B. | 第三周期第ⅡA族 | C. | 第四周期第IA族 | D. | 第四周期第ⅡA族 |
19.对于反应:2Na2O2+2CO2═2Na2CO3+O2,被氧化的氧原子与被还原的氧原子的个数之比为( )
| A. | 1:1 | B. | 2:1 | C. | 3:1 | D. | 1:2 |
6.环境问题是现在社会急需解决的问题,有报道说:现在全球癌症的发病率呈上升趋势.有消息称:${\;}_{67}^{166}Ho$可有效地治疗肝癌,该原子核内的中子数与核外电子数之差为( )
| A. | 67 | B. | 32 | C. | 99 | D. | 166 |
3.请你完成下表中1-8处的空白.
①98g/mol,②1mol,③18,④6.0201×1023,⑤17g/mol,⑥1mol,⑦56,⑧6.0200×1023.
| 物质及其质量 | 相对原子质量或相对分子质量 | 摩尔质量 | 物质的量 | 一个粒子的质量 | 所含粒子的数目 |
| 98gH2SO4 | 98 | ① | ② | 1.628×10-22g | 6.0197×1023 |
| 18gHN4+ | ③ | 18g/mol | l mol | 2.9900×10-23g | ④ |
| 17gOH- | 17 | ⑥ | ⑥ | 2.8239×10-23g | 6.0200×1023 |
| 56gFe | ⑦ | 56g/mol | l mol | 9.3023×10-23g | ⑧ |