题目内容
2.银锌电池广泛用作各种电子仪器的电源,其电极分别为Ag2O、Zn,电解质溶液为KOH溶液,总反应为Ag2O+Zn+H2O═2Ag+Zn(OH)2.下列说法中错误的是( )| A. | 工作时,负极上发生反应的物质是Zn | |
| B. | 溶液中OH-向正极移动,K+、H+向负极移动 | |
| C. | 工作时,负极区溶液氢氧根浓度减小 | |
| D. | 正极上发生的反应是Ag2O+H2O+2e-═2Ag+2OH- |
分析 根据电池反应式知,Zn失电子发生氧化反应而作负极,氧化银作正极,负极发生反应Zn+2OH--2e-=ZnO+H2O,溶液pH值减小,正极上发生反应:Ag2O+H2O+2e-═2Ag+2OH-,溶液pH增大,放电时,电解质溶液中阴离子向负极移动、阳离子向正极移动,据此分析解答.
解答 解:A.根据电池反应式知,放电时Zn元素化合价由0价变为+2价,所以负极上Zn失电子发生氧化反应,故A正确;
B.放电时,电解质溶液中阴离子向负极移动、阳离子向正极移动,所以溶液中OH-向负极移动,K+、H+向正极移动,故B错误;
C.负极发生反应Zn+2OH--2e-=ZnO+H2O,氢氧根离子参加反应导致氢氧根离子浓度降低,故C正确;
D.正极反应式为Ag2O+H2O+2e-═2Ag+2OH-,故D正确;
故选B.
点评 本题考查化学电源新型电池,为高频考点,根据电池反应式元素化合价变化确定正负极,难点是电极反应式的书写,要结合电解质溶液酸碱性书写,题目难点中等.

练习册系列答案
相关题目
12.不慎接触到敌敌畏或甲胺磷时可以用碱性溶液处理因为它们是( )
| A. | 醛类 | B. | 有机物 | C. | 酯类 | D. | 盐类 |
13.下列说法正确的是( )
| A. | 药品柜的同一层不可存放浓硝酸和浓氨水 | |
| B. | 保存在无色玻璃试剂瓶中的浓硝酸要放在阴凉处 | |
| C. | 铵态氮肥可与草木灰混合雨天施用 | |
| D. | 固氮就是将氮元素转化成固体 |
10.NA为阿伏伽德罗常数,下列叙述错误的是( )
| A. | 17gNH3中含有的质子数为10NA | |
| B. | 12g金刚石中含有的共价键数为4 NA | |
| C. | 46gNO2和N2O4混合气体中含有的原子总数为3 NA | |
| D. | 1molNa与足量的O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
17.已知短周期元素的离子aA2+、bB+、cC2-、dD-都具有相同的核外电子排布,则下列叙述正确的是( )
| A. | 原子半径D<C<B<A | B. | 原子序数 d>c>a>b | ||
| C. | 离子半径C>D>B>A | D. | 单质的氧化性C>D>A>B |
11.下列各组顺序的排列错误的是( )
| A. | 离子半径:Na+>Mg2+>Al3+>F- | B. | 热稳定性:HCl>H2S>PH3>AsH3 | ||
| C. | 酸性:HAlO2<H2SiO3<H2CO3<H3PO4 | D. | 熔点:金刚石>NaCl>Na>CO2 |
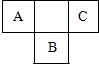 A、B、C为短周期元素,在周期表中所处位置如图所示.
A、B、C为短周期元素,在周期表中所处位置如图所示.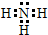 ;
;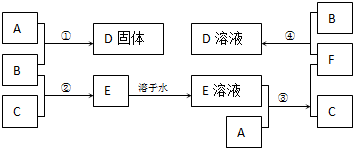 室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适的反应条件下,它们可以按下面的框图进行反应.又知E溶液是无色的.
室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适的反应条件下,它们可以按下面的框图进行反应.又知E溶液是无色的.