题目内容
9.0.05mol某金属单质与足量的盐酸反应,放出1.12LH2(标准状况),并转变为具有Ne原子的电子层结构的离子,该金属元素在元素周期表中的位置是( )| A. | 第三周期第IA族 | B. | 第三周期第ⅡA族 | C. | 第四周期第IA族 | D. | 第四周期第ⅡA族 |
分析 金属与盐酸的反应为氧化还原反应,金属失去电子等于H得到电子,由金属元素的化合价及离子具有Ne原子的电子层结构可知原子序数,然后确定元素及位置.
解答 解:0.05mol某金属单质与足量的盐酸反应,放出1.12LH2(标准状况),
设金属反应后元素的化合价为x,
由电子守恒可知0.05mol×(x-0)=$\frac{1.12L}{22.4L/mol}$×2×(1-0),
解得x=+2,
离子具有Ne原子的电子层结构,则金属的原子序数为10+2=12,即为Mg元素,位于第三周期第ⅡA族,
故选B.
点评 本题考查化学反应方程式的计算,为高频考点,把握电子守恒为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
19.M、X、Y、Z是四种元素,其常见化合价均为+2价,且X2+与单质M不反应;X2++Z═X+Z2+;Y+Z2+═Y2++Z;这四种离子的氧化性大小符合( )
| A. | M2+>X2+>Z2+>Y2+ | B. | X2+>M2+>Y2+>Z2+ | C. | Y2+>Z2+>M2+>X2+ | D. | Z2+>X2+>M2+>Y2+ |
17.已知短周期元素的离子aA2+、bB+、cC2-、dD-都具有相同的核外电子排布,则下列叙述正确的是( )
| A. | 原子半径D<C<B<A | B. | 原子序数 d>c>a>b | ||
| C. | 离子半径C>D>B>A | D. | 单质的氧化性C>D>A>B |
4.下列说法正确的是( )
| A. | HF、HCl、HBr、HI的热稳定性依次减弱与分子间作用力有关 | |
| B. | 因为亚硫酸比碳酸的酸性强,所以硫的非金属性比碳强 | |
| C. | Li、B、Be、C、N、O、F 原子序数依次增大 | |
| D. | 乙醇与二甲醚互为同分异构体 |
18.学好化学用语是学好化学的基础,化学用语的书写必须十分规范与准确,请用化学用语回答下列问题:
(1)这10种元素中,化学性质最不活泼的元素是Ne,得电子能力最强的原子氢化物的分子式是HF,⑥元素最高价氧化物的电子式 ,④离子的核外电子排布示意图
,④离子的核外电子排布示意图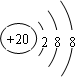 .
.
⑦、⑨两种元素最高价氧化物对应水化物的化学式分别为:H3PO4、HClO4;
⑦元素气态氢化物的稳定性小于⑨元素气态氢化物的稳定性(填大于、等于或小于)
(2)失电子能力最强的单质与水反应的化学方程式是2K+2H2O=2KOH+H2↑
(3)写出③的单质置换出⑥的单质的化学方程式2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C.
①和⑤两种元素最高价氧化物对应的水化物相互反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ⑧ | ⑩ | |||||
| 3 | ① | ③ | ⑤ | ⑦ | ⑨ | |||
| 4 | ② | ④ |
 ,④离子的核外电子排布示意图
,④离子的核外电子排布示意图 .
.⑦、⑨两种元素最高价氧化物对应水化物的化学式分别为:H3PO4、HClO4;
⑦元素气态氢化物的稳定性小于⑨元素气态氢化物的稳定性(填大于、等于或小于)
(2)失电子能力最强的单质与水反应的化学方程式是2K+2H2O=2KOH+H2↑
(3)写出③的单质置换出⑥的单质的化学方程式2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C.
①和⑤两种元素最高价氧化物对应的水化物相互反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O.
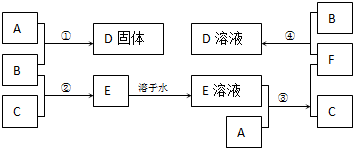 室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适的反应条件下,它们可以按下面的框图进行反应.又知E溶液是无色的.
室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适的反应条件下,它们可以按下面的框图进行反应.又知E溶液是无色的.