题目内容
4.有33.2g KClO3和MnO2的混合物,加热至不再产生气体为止,质量变为23.6g,冷却后加入一定质量蒸馏水,搅拌,再过滤,得到滤渣和100mL滤液.已知:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,求:(1)在上述滤渣中加入足量的浓盐酸,充分加热,制得的氯气的体积(在标准状况下)是多少升?
(2)所得的100mL滤液中溶质的物质的量浓度是多少?
(3)取100mL滤液,加入足量的用硝酸酸化的AgNO3溶液,可得到沉淀多少克?
分析 (1)根据质量守恒定律可知,固体减少的质量就是生成的氧气的质量,据此计算混合物中KClO3和MnO2的质量,再根据MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O计算氯气的体积;
(2)根据KClO3与MnO2的混合物受热分解的方程式,由氧气的质量可求出生成的氯化钾的物质的量,再计算物质的量浓度;
(3)根据氯化钾与硝酸银反应的方程式,由氯化钾的物质的量计算得到.
解答 解:(1)由质量守恒定律可知,生成的氧气的质量为33.2-23.6=9.6g,设混合物中KClO3的质量为x
2KClO3 $\frac{\underline{\;MnO_{2}\;}}{\;}$2KCl+3O2↑
245 96
x 9.6g
解得:x=24.5g,所以MnO2的质量为33.2-24.5=8.7g;
再根据MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,所以制得的氯气的体积(在标准状况下)是$\frac{8.7}{87}$×22.4=2.24L;
答:制得的氯气的体积(在标准状况下)是2.24L;
(2)设生成的氯化钾的物质的量为y
2KClO3 $\frac{\underline{\;MnO_{2}\;}}{\;}$2KCl+3O2↑
2 96
y 9.6g
解得:y=0.2mol
所以所得的100mL滤液中溶质的物质的量浓度是$\frac{0.2}{0.1}$=2mol/L,
答:所得的100mL滤液中溶质的物质的量浓度是2mol/L;
(3)设生成AgCl的质量为z
KCl+AgNO3═AgCl↓+KNO3
1 101
0.2 z
解得:z=20.2g
答:可得到沉淀20.2g.
点评 本题主要考查了根据化学方程式的计算,解答时首先要理解和熟记根据化学反应方程式的计算步骤和格式,以及与之相关的知识等.

| A. | 盐酸 | B. | 氢氧化钠溶液 | C. | 氨水 | D. | 水 |
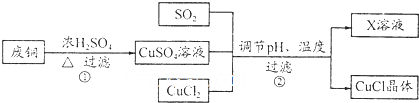
(l)写出过程①的主要化学方程式Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)分析下表,析出CuCl晶体时的最佳pH为2;当pH较大时,CuCI晶体产率较低,其原因是pH增大,Cu2+水解损失增加.
| pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| CuCl产率(%) | 70 | 90 | 82 | 78 | 75 | 72 | 70 |
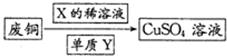
(4)为了更好体现绿色化学思想,有人提出如下方案:方案一:可将上述X稀溶液用于废铜的处理(如图所示),则Y可以为O2(填化学式).
方案二:①中Cu与浓H2SO4反应所得SO2和CuSO4用于②中CuCl的制备,理论上不需要(“需要”或“不需要”)另外补充SO2,原因是反应①Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O中生成的CuSO4和SO2的物质的量之比为1:1,而反应②CuSO4+CuCl2+SO2+2H2O═2Cucl↓+2H2SO4需要的CuSO4和SO2的物质的量之比也恰好为1:1,所以理论上不需要补充SO2(结合化学方程式回答).
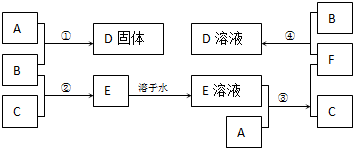 室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适的反应条件下,它们可以按下面的框图进行反应.又知E溶液是无色的.
室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适的反应条件下,它们可以按下面的框图进行反应.又知E溶液是无色的.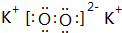 ;
;