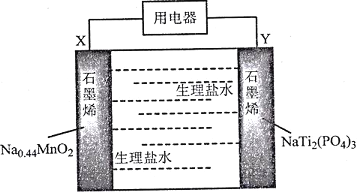
题目内容
【题目】常温下,部分酸的电离平衡常数如下:
化学式 | HF | HCN | H2CO3 |
电离常数 | Ka=3.5×10-4 | Ka=5.0×10-10 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
(1)c(H+)相同的三种酸溶液的浓度从大到小为___。
(2)若HCN溶液的起始浓度为0.01mol·L-1,平衡时c(H+)约为__mol·L-1。使此溶液中HCN的电离程度增大且c(H+)也增大的方法是__。
(3)中和等量的NaOH,消耗等pH的氢氟酸和硫酸的体积分别为aL、bL,则a__(填“大于”“小于”或“等于”,下同)b。中和等浓度、等体积的氢氟酸和硫酸需要NaOH的物质的量为n1、n2,则n1__n2。
(4)向NaCN溶液中通入少量的CO2,发生反应的离子方程式为__。
(5)设计实验证明氢氟酸比HCl的酸性弱__。
【答案】c(HCN)>c(H2CO3)>c(HF) ![]() ×10-6 升高温度 小于 小于 CN-+CO2+H2O=HCN+HCO
×10-6 升高温度 小于 小于 CN-+CO2+H2O=HCN+HCO![]() 测定等浓度的两种酸溶液的pH,氢氟酸的pH大或等浓度的两种酸溶液分别与Zn反应,初始时氢氟酸冒气泡慢
测定等浓度的两种酸溶液的pH,氢氟酸的pH大或等浓度的两种酸溶液分别与Zn反应,初始时氢氟酸冒气泡慢
【解析】
(1)根据三种酸的电离平衡常数可知,酸性:HF>H2CO3>HCN>HCO3-。因此c (H+)相同的三种酸,其酸的浓度从大到小的顺序为c (HCN)>c (H2CO3) >c (HF),故答案为c (HCN)>c (H2CO3) >c (HF);
(2)设c(H+)=x,根据HCN![]() H++CN-,Ka=5.0×10-10=
H++CN-,Ka=5.0×10-10=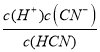 =
=![]() ,解得x≈
,解得x≈![]() ×10-6,弱电解质的电离过程是吸热过程,升高温度,能够促进HCN的电离,电离程度增大,c(H+)也增大,故答案为
×10-6,弱电解质的电离过程是吸热过程,升高温度,能够促进HCN的电离,电离程度增大,c(H+)也增大,故答案为![]() ×10-6;升高温度;
×10-6;升高温度;
(3)中和等量的NaOH,需要消耗等物质的量的氢离子,当氢氟酸和硫酸的pH相等时,由于硫酸是强酸,氢氟酸为弱酸,需要氢氟酸和硫酸的体积比小于1:1,即a小于b。氢氟酸为一元酸、硫酸为二元酸,中和等浓度、等体积的氢氟酸和硫酸需要NaOH的物质的量为1:2,即n1小于n2,故答案为小于;小于;
(4)酸性:HF>H2CO3>HCN>HCO3-。向NaCN中通入少量的CO2反应生成HCN和NaHCO3,反应的离子方程式为CN-+CO2+H2O=HCN+HCO3-,故答案为CN-+CO2+H2O=HCN+HCO3-;
(5)证明氢氟酸比盐酸的酸性弱可以使用的方法有:①测定等浓度的两种酸的pH,氢氟酸的pH大;②等浓度的两种酸分别与Zn反应,初始氢氟酸冒气泡慢;③测定等物质的量浓度的两种溶液的导电性,盐酸的灯泡较亮、氢氟酸的灯泡较暗等,故答案为:测定等浓度的两种酸的pH,氢氟酸的pH大或等浓度的两种酸分别与Zn反应,初始氢氟酸冒气泡慢。

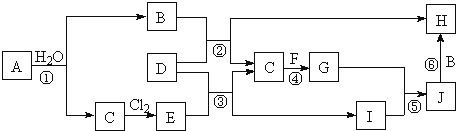
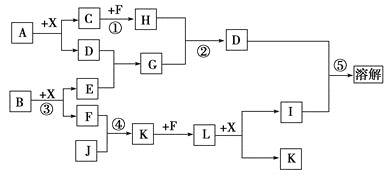
【题目】镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害。某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下:
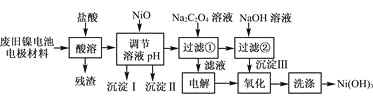
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②已知实验温度时的溶解度:NiC2O4>NiC2O4·H2O>NiC2O4·2H2O
③某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如下表所示:
|
| 开始沉淀pH | 沉淀完全pH |
|
|
|
|
|
|
|
|
|
|
|
|
回答下列问题:
(1) 用NiO调节溶液的pH,依次析出沉淀Ⅰ________和沉淀Ⅱ__________(填化学式)。
(2) 写出加入Na2C2O4溶液的反应的化学方程式:_____________________。
(3) 检验电解滤液时阳极产生的气体的方法:___________________________。
(4) 写出“氧化”反应的离子方程式:___________________________________。
(5) 如何检验Ni(OH)3已洗涤干净?_______________________。
【题目】下列实验操作规范且能达到实验目的的是
操作 | 目的 | |
A | 称取5.0gCuSO4·5H2O加入27.0g水中,搅拌溶解 | 配制10%CuSO4溶液 |
B | 先用稀盐酸洗涤,再用水清洗 | 洗涤分解KMnO4制O2的试管 |
C | 用玻璃棒蘸取溶液,点在干燥的pH试纸上,片刻后与标准比色卡比较并读数 | 测定0.05mol.L-1NaClO溶液的pH |
D | 将粗碘放入烧杯中,烧杯口放一盛满冷水的烧瓶,隔石棉网对烧杯加热,然后收集烧瓶外壁的固体 | 提纯混有NH4Cl的粗碘 |
A. A B. B C. C D. D