题目内容
【题目】我国科学家发明了一种安全可充电的柔性水系钠离子电池,可用生理盐水或细胞培养基为电解质,电池放电的总反应式为:Na0.44MnO2+NaTi2(PO4)3=Na0.44-xMnO2+Na1+xTi2(PO4)3,其工作原理如下图。
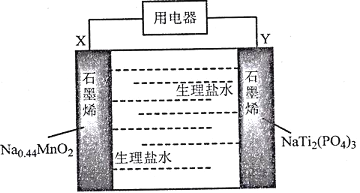
下列说法错误的是
A. 放电时,Cl-向X极移动
B. 该电池充电时Y极应该与电源的正极相连
C. 充电时,阴极反应为:NaTi2(PO4)3+xNa++xe-=Na1+ xTi2( PO4)3
D. 该电池可能作为可植入人体的电子医疗设备的电源
【答案】C
【解析】
A.根据放电反应方程式可知:在反应中Na0.44MnO2失去电子变为Na0.44-xMnO2,Mn元素化合价升高,因此X电极为负极,电池工作时,溶液中的阴离子Cl-向负极X区移动,A正确;
B.根据反应方程式可知放电时,X电极为负极,负极发生氧化反应,Y电极为正极,正极上发生还原反应,则该电池充电时Y极应该与电源的正极相连,作阳极,发生氧化反应,B正确;
C.充电时,X电极与电源的负极连接,作阴极,阴极反应为:Na0.44-xMnO2+xe-+xNa+= Na0.44MnO2,C错误;
D.该电池是一种安全可充电的柔性水系电池,因此可能作为可植入人体的电子医疗设备的电源,D正确;
故合理选项是C。

【题目】化学理论较为枯燥,若用化学实验来阐释理论,则会使理论具有趣味性,某班级化学学习小组通过实验室制备CO2的反应探究某些化学理论。下表是实验过程中的数据及相关信息:
序号 | 反应 温度/℃ | c(HCl)/(mol·L-1) | V(HCl)/mL | 10g CaCO3 的形状 | t/min |
① | 20 | 2 | 10 | 块状 | t1 |
② | 20 | 4 | 10 | 块状 | t2 |
③ | 20 | 2 | 10 | 粉状 | t3 |
④ | 40 | 2 | 10 | 粉状 | t4 |
⑤ | 40 | 4 | 10 | 粉状 | t5 |
![]() 表示收集CO2体积为a mL所需的时间。注:气体体积均在相同条件下测得。
表示收集CO2体积为a mL所需的时间。注:气体体积均在相同条件下测得。
(1)由表中的信息可知,实验的目的是探究__________。
(2)表格中的实验①和实验②是探究_____对化学反应速率的影响。分析表格中的信息可知,影响该化学反应速率的因素还有______________________________。
(3)收集a mLCO2所需的时间最少的是实验______________________________。
【题目】常温下,部分酸的电离平衡常数如下:
化学式 | HF | HCN | H2CO3 |
电离常数 | Ka=3.5×10-4 | Ka=5.0×10-10 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
(1)c(H+)相同的三种酸溶液的浓度从大到小为___。
(2)若HCN溶液的起始浓度为0.01mol·L-1,平衡时c(H+)约为__mol·L-1。使此溶液中HCN的电离程度增大且c(H+)也增大的方法是__。
(3)中和等量的NaOH,消耗等pH的氢氟酸和硫酸的体积分别为aL、bL,则a__(填“大于”“小于”或“等于”,下同)b。中和等浓度、等体积的氢氟酸和硫酸需要NaOH的物质的量为n1、n2,则n1__n2。
(4)向NaCN溶液中通入少量的CO2,发生反应的离子方程式为__。
(5)设计实验证明氢氟酸比HCl的酸性弱__。