题目内容
【题目】工业上以CO和H2为原料合成甲醇的反应:CO(g)+2H2(g)![]() CH3OH(g) △H<0,在容积为1 L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。下列说法不正确的是( )
CH3OH(g) △H<0,在容积为1 L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。下列说法不正确的是( )
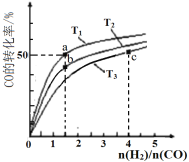
A. H2转化率:a>b>c
B. 上述三种温度之间关系为T1>T2>T3
C. a点状态下再通入0.5 mol CO和0.5 molCH3OH,平衡不移动
D. c点状态下再通入1 molCO和4 mol H2,新平衡中H2的体积分数减小
【答案】B
【解析】
A.由图可知,当n(H2)/n(CO)=1.5时,CO的转化率a![]() b且大于T3下对应CO的转化率,当在温度为T3时,随着n(H2)/n(CO)增大,CO的妆化率增大,H2的转化率减小,所以有a>b>c,故A正确;
b且大于T3下对应CO的转化率,当在温度为T3时,随着n(H2)/n(CO)增大,CO的妆化率增大,H2的转化率减小,所以有a>b>c,故A正确;
B.根据CO(g)+2H2(g)![]() CH3OH(g) △H<0,因为是放热反应,温度升高CO的转化率减小,由图可以看出,当n(H2)/n(CO)相等时,T3
CH3OH(g) △H<0,因为是放热反应,温度升高CO的转化率减小,由图可以看出,当n(H2)/n(CO)相等时,T3![]() T2
T2![]() T1,故B错误;
T1,故B错误;
C.a点时,CO的转化率为50![]() ,起始时CO的物质的量为1mol,H2的物质的量为1.5mol,由此计算平衡常数为4,通过计算再通入0.5 mol CO和0.5 molCH3OH,的浓度商Qc=4,所以平衡不移动,故C正确;
,起始时CO的物质的量为1mol,H2的物质的量为1.5mol,由此计算平衡常数为4,通过计算再通入0.5 mol CO和0.5 molCH3OH,的浓度商Qc=4,所以平衡不移动,故C正确;
D. c点状态下再通入1 molCO和4 mol H2,在等温等容的条件下,投料比不变,相当于加压,平衡向正反应方向移动,新平衡H2的体积分数减小,故D正确;
本题答案为B。

【题目】碳是自然界中形成化合物种类最多的元素,CO和CO2是碳的最常见氧化物。
(1)研究和解决二氧化碳捕集和转化问题是当前科学研究的前沿领域。在太阳能的作用下,缺铁氧化物[Fe0.9O]能分解CO2,其过程如图1所示。过程①的化学方程式是______。在过程②中每产生0.1molO2,转移电子______mol。

(2)在催化剂作用下,将二氧化碳和氢气混合反应生成甲烷,是目前科学家们正在探索的处理空气中的二氧化碳的方法之一。
①已知:
共价键 | C=O | H—H | C—H | O—H |
键能/(kJmol-1) | 745 | 436 | 413 | 463 |
则CO2(g)+4H2(g)![]() CH4(g)+2H2O(g) △H=______kJmol-1。
CH4(g)+2H2O(g) △H=______kJmol-1。
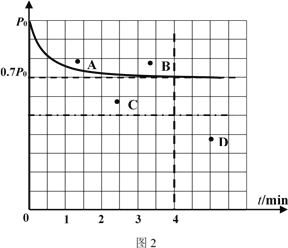
②向1L固定容积的密闭容器中加入4.0 mol H2(g)、1.0mol CO2,控制条件(催化剂:铑—镁合金、高温T1)使之反应,若测得容器内气体的压强随着时间的变化如图2所示。则4 min时容器内气体的密度为______;温度T1 下,该反应的化学平衡常为______。若采用2 L固定容积的密闭容器,投料量、催化剂和反应温度均保持不变,则反应重新达到平衡时对应体系内的压强的点是______(填字母)。
(3)工业合成原料气CO会与设备、管道及催化剂表面的金属铁、镍反应,生成羰基化合物。四羰基镍是热分解法制备高纯镍的原料,也是有机合成中供给一氧化碳的原料,还可做催化剂。Ni(s)+4CO(g)![]() Ni(CO)4(g) △H<0 Ni(CO)4(g)
Ni(CO)4(g) △H<0 Ni(CO)4(g)![]() Ni(s)+4CO(g)。如图3所示,在石英真空管的温度为T1一端,放入少量粗镍和CO(g),一段时间后,在温度为T2的一端可得到纯净的镍。则温度T1______T2(填“>”“<”或“=”),上述反应体系中循环使用的物质为______(填化学式)。
Ni(s)+4CO(g)。如图3所示,在石英真空管的温度为T1一端,放入少量粗镍和CO(g),一段时间后,在温度为T2的一端可得到纯净的镍。则温度T1______T2(填“>”“<”或“=”),上述反应体系中循环使用的物质为______(填化学式)。