题目内容
2.下列鉴别实验中,所选试剂不合理的是( )| A. | 用水鉴别乙醇和苯 | |
| B. | 用碳酸氢钠溶液鉴别乙酸和乙醇 | |
| C. | 用新制的氢氧化铜悬浊液鉴别葡萄糖和蔗糖 | |
| D. | 用溴的四氯化碳溶液鉴别裂解气和焦炉气 |
分析 A.乙醇易溶于水,而苯与水互不相溶;
B.乙酸与碳酸氢钠反应生成二氧化碳气体;
C.葡萄糖为还原性糖;
D.裂解气和焦炉气都含有不饱和烃.
解答 解:A.乙醇易溶于水,而苯与水互不相溶,溶液分层,可鉴别,故A不选;
B.乙酸的酸性比碳酸强,可与碳酸氢钠反应生成二氧化碳气体,乙醇不反应,可鉴别,故B不选;
C.葡萄糖为还原性糖,可与氢氧化铜浊液发生氧化还原反应,而蔗糖不反应,不能鉴别,故C不选;
D.裂解气和焦炉气都含有不饱和烃,应溴的四氯化碳溶液不能鉴别,故D选.
故选D.
点评 本题考查物质的鉴别,为高频考点和常见题型,侧重于学生的分析、实验能力的考查,注意把握物质的性质的异同,为解答该类题目的关键,难度不大.

练习册系列答案
相关题目
19.下列说法正确的是( )
| A. | 由${\;}_{1}^{2}$H和${\;}_{8}^{18}$O所组成的11g水中所含中子数为6NA | |
| B. | H2O和D2O互称为同素异形体,且两者的化学性质相似 | |
| C. | ${\;}_{8}^{18}$O2和${\;}_{8}^{16}$O3互称为同位素 | |
| D. | 金刚石和石墨互为同素异形体,两者之间的转化属于物理变化 |
13. Ⅰ.常温下,某水溶液中只存在下列四种离子:Na+、A-、H+、OH-,据题意回答下列问题.
Ⅰ.常温下,某水溶液中只存在下列四种离子:Na+、A-、H+、OH-,据题意回答下列问题.
(1)若由0.2mol/L的HA溶液与0.2mol/L的NaOH溶液等体积混合后混合液的pH>7,则混合溶液中各种离子浓度由大到小的顺序是:c(Na+)>c(A-)>c(OH-)>c(H+).
(2)若HA为弱酸,现有两组溶液
A组:由0.4mol/L的HA溶液与0.2mol/L的NaOH溶液等体积混合后混合液的pH<7;
B组:0.1mol/L的HA溶液
①A组溶液pH<7的原因:等浓度时弱酸HA电离大于A-离子水解.
②两组溶液中c(A-)的大小,A组>B组(填“>”“<”或“=”);溶液中水的电离程度A组>B组(填“>”“<”或“=”).
(3)若HA为强酸,若是pH=2HA V1mL与pH=12Ba(OH)2 V2 mL混合后得到pH=11的溶液,则$\frac{{V}_{1}}{{V}_{2}}$=$\frac{9}{11}$
Ⅱ、现有浓度为0.1mol•L-1的五种电解质溶液①NaHSO4;②NaHCO3;③NaCl;④CH3COONa;⑤NaOH
(1)这五种溶液的pH由小到大的顺序是①<③<④<②<⑤(填编号).
(2)在上述五种溶液中分别加入Al2(SO4)3溶液,能产生大量无色无味气体的是②(填编号);其离子反应方程式为:3HCO3-+Al3+=Al(OH)3↓+3CO2↑.
Ⅲ.已知:
(1)在浓度均为0.01mol/L的CH3COONa、NaClO、Na2CO3的混合溶液中,逐滴加入0.01mol/L HCl,则体系中酸根离子反应的先后顺序为CO32-、ClO-、CH3COO-;(填酸根离子符号)
(2)25℃时,向20mL 0.1mol/L CH3COOH溶液中逐滴滴加0.1mol/L NaOH溶液,体系中各种量随着NaOH溶液的加入而变化的图象正确的是D.
 Ⅰ.常温下,某水溶液中只存在下列四种离子:Na+、A-、H+、OH-,据题意回答下列问题.
Ⅰ.常温下,某水溶液中只存在下列四种离子:Na+、A-、H+、OH-,据题意回答下列问题.(1)若由0.2mol/L的HA溶液与0.2mol/L的NaOH溶液等体积混合后混合液的pH>7,则混合溶液中各种离子浓度由大到小的顺序是:c(Na+)>c(A-)>c(OH-)>c(H+).
(2)若HA为弱酸,现有两组溶液
A组:由0.4mol/L的HA溶液与0.2mol/L的NaOH溶液等体积混合后混合液的pH<7;
B组:0.1mol/L的HA溶液
①A组溶液pH<7的原因:等浓度时弱酸HA电离大于A-离子水解.
②两组溶液中c(A-)的大小,A组>B组(填“>”“<”或“=”);溶液中水的电离程度A组>B组(填“>”“<”或“=”).
(3)若HA为强酸,若是pH=2HA V1mL与pH=12Ba(OH)2 V2 mL混合后得到pH=11的溶液,则$\frac{{V}_{1}}{{V}_{2}}$=$\frac{9}{11}$
Ⅱ、现有浓度为0.1mol•L-1的五种电解质溶液①NaHSO4;②NaHCO3;③NaCl;④CH3COONa;⑤NaOH
(1)这五种溶液的pH由小到大的顺序是①<③<④<②<⑤(填编号).
(2)在上述五种溶液中分别加入Al2(SO4)3溶液,能产生大量无色无味气体的是②(填编号);其离子反应方程式为:3HCO3-+Al3+=Al(OH)3↓+3CO2↑.
Ⅲ.已知:
| 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) |
| CH3COOH | 1.8×10-5 | HCN | 5×10-10 |
| H2CO3 | Ka1=4.2×10-7 | HClO | 3×10-8 |
| Ka2=5.6×10-11 |
(2)25℃时,向20mL 0.1mol/L CH3COOH溶液中逐滴滴加0.1mol/L NaOH溶液,体系中各种量随着NaOH溶液的加入而变化的图象正确的是D.
11.根据周期表结构及元素性质变化趋势判断,下列关于ⅠA元素说法错误的是( )
①铷是有较高熔点的金属单质
②铯在化合物中呈+1价
③锂可能与水反应,但不熔化成小球
④锂金属性很活泼,故要保存在煤油中
⑤钾单质与水反应剧烈,会在水中上下浮动.
①铷是有较高熔点的金属单质
②铯在化合物中呈+1价
③锂可能与水反应,但不熔化成小球
④锂金属性很活泼,故要保存在煤油中
⑤钾单质与水反应剧烈,会在水中上下浮动.
| A. | ②③④ | B. | ①③⑤ | C. | ①②⑤ | D. | ①④⑤ |
12. 如图所示的直型石英玻璃封管中充有CO气体,左端放置不纯的镍(Ni)粉.在一定条件下,Ni可以与CO(g)发生如下反应:Ni(s)+4CO(g)$?_{453~473K}^{323~353K}$Ni(CO)4(g)
如图所示的直型石英玻璃封管中充有CO气体,左端放置不纯的镍(Ni)粉.在一定条件下,Ni可以与CO(g)发生如下反应:Ni(s)+4CO(g)$?_{453~473K}^{323~353K}$Ni(CO)4(g)
但Ni粉中的杂质不与CO(g)发生反应.玻璃管内左右两端的温度分别稳定在350K和470K,经过足够长时间后,下列说法正确的是( )
 如图所示的直型石英玻璃封管中充有CO气体,左端放置不纯的镍(Ni)粉.在一定条件下,Ni可以与CO(g)发生如下反应:Ni(s)+4CO(g)$?_{453~473K}^{323~353K}$Ni(CO)4(g)
如图所示的直型石英玻璃封管中充有CO气体,左端放置不纯的镍(Ni)粉.在一定条件下,Ni可以与CO(g)发生如下反应:Ni(s)+4CO(g)$?_{453~473K}^{323~353K}$Ni(CO)4(g)但Ni粉中的杂质不与CO(g)发生反应.玻璃管内左右两端的温度分别稳定在350K和470K,经过足够长时间后,下列说法正确的是( )
| A. | 在石英管右端主要物质是Ni(CO)4(g) | |
| B. | 在石英管右端主要物质是纯Ni(s)和CO(g) | |
| C. | 在石英管左端主要物质是纯Ni(s)和CO(g) | |
| D. | 整个过程可以看作CO(g)将Ni(s)从石英管左端转移到右端,从而达到提纯目的 |
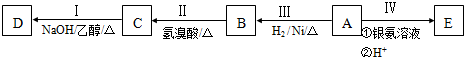
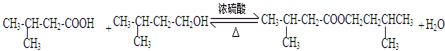 ;
;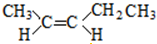 、
、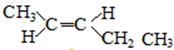 ;
; .
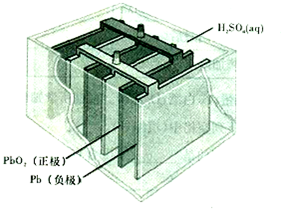
.
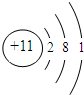 ;
; 有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取.纯净的A为无色黏稠液体,易溶于水.为研究A的组成与结构,进行了如下实验:
有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取.纯净的A为无色黏稠液体,易溶于水.为研究A的组成与结构,进行了如下实验: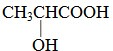 .
.