题目内容
7.在人类已知的化合物中,种类最多的是( )| A. | 过渡元素形成的化合物 | B. | ⅢA族元素形成的化合物 | ||
| C. | ⅣA族元素形成的化合物 | D. | ⅦA族元素形成的化合物 |
分析 在人类已知的化合物中,90%以上是有机物,大多数含有碳元素的化合物属于有机物,依据碳元素在周期表中的位置解答.
解答 解:在人类已知的化合物中,90%以上是有机物,大多数含有碳元素的化合物属于有机物,碳元素在周期表中位于第二周期,第ⅣA族,
故选:C.
点评 本题考查了本题考查有机物的特点,明确碳原子成键方式的多样性是有机物种类繁多的原因是解题关键,题目难度不大.

练习册系列答案
 优等生题库系列答案
优等生题库系列答案
相关题目
17.如图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略).
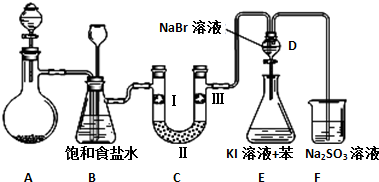
(1)制备氯气选用的药品为漂粉精固体和浓盐酸,相关的化学反应方程式为Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O;
(2)装置B中饱和食盐水的作用是除去Cl2中的HCl,同时装置B亦是安全瓶,可用来监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象B中长颈漏斗中液面上升,形成水柱;
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入物质的组合是d(填编号);
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性.反应一段时间后,打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是E中溶液分为两层,上层(苯层)为紫红色,事实上该现象并不能说明溴的非金属性强于碘,原因是Cl2+2I-=I2+2Cl-(用离子反应方程式解释);
(5)从原子结构角度解释氯、溴、碘的非金属性强弱递变规律及原因氯、溴、碘同主族,从上到下,原子半径逐渐增大,得电子能力减弱,元素非金属性减弱;
(6)装置F的目的是吸收余氯,试写出相应的离子反应方程式SO32-+Cl2+H2O=SO42-+2Cl-+2H+.

(1)制备氯气选用的药品为漂粉精固体和浓盐酸,相关的化学反应方程式为Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O;
(2)装置B中饱和食盐水的作用是除去Cl2中的HCl,同时装置B亦是安全瓶,可用来监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象B中长颈漏斗中液面上升,形成水柱;
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入物质的组合是d(填编号);
| 编号 | a | b | c | d |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(5)从原子结构角度解释氯、溴、碘的非金属性强弱递变规律及原因氯、溴、碘同主族,从上到下,原子半径逐渐增大,得电子能力减弱,元素非金属性减弱;
(6)装置F的目的是吸收余氯,试写出相应的离子反应方程式SO32-+Cl2+H2O=SO42-+2Cl-+2H+.
15.某种有机物2mol在氧气中充分燃烧,共消耗5mol氧气,生成二氧化碳和水各4mol,由此可以得到的结论是( )
| A. | 该有机物分子中不含有氧原子 | |
| B. | 该有机物分子中含一个氧原子 | |
| C. | 该有机物一个分子中含2个氧原子 | |
| D. | 不能确定该有机物分子中是否含有氧原子及其个数 |
2.下列操作正确的是( )
| A. | 制溴苯时,将导气管插入水中使其充分吸收尾气 | |
| B. | 配制新制Cu(OH)2悬浊液:在一定量CuSO4溶液中,滴加少量NaOH溶液 | |
| C. | 只用溴水一种试剂可鉴别出甲苯、己烯、乙醇、四氯化碳四种液体 | |
| D. | 制取乙酸乙酯实验中,在一定量乙醇中,依次加入0.5mol/L的H2SO4和乙酸后加热 |
12.常温下,下列物质的溶液pH>7的是( )
| A. | K2SO4 | B. | NH4Cl | C. | Na2CO3 | D. | Cu(NO3)2 |
19.下列说法中,正确的是( )
| A. | 甲烷与乙烯共1mol,完全燃烧后生成的H2O为2mol | |
| B. | 光照下,异丁烷与Cl2发生取代反应生成的一氯代物有三种 | |
| C. | 在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH | |
| D. | 用核磁共振氢谱不能区分HCOOCH3和HCOOCH2CH3 |
16.下列说法正确的是( )
| A. | 按系统命名法,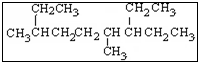 名称:4,7-二甲基-3-乙基壬烷 名称:4,7-二甲基-3-乙基壬烷 | |
| B. | 元素分析仪可以同时对碳、氢、氧、硫等多种元素进行分析 | |
| C. | 用相同浓度的乙醇和苯酚水溶液,分别与相同质量的金属钠反应,来比较两者羟基上氢的活性 | |
| D. | 等质量的下列物质燃烧耗O2量:乙炔>乙烯>乙烷 |
17.如图是部分短周期元素原子半径与原子序数的关系图,下列说法不正确的是( )

| A. | N、Z两种元素的离子半径相比前者较大 | |
| B. | M、N两种元素的气态氢化物的稳定性相比后者较强 | |
| C. | X与M两种元素组成的化合物能与碱反应,但不能与任何酸反应 | |
| D. | X与Y两种元素组成的一种化合物中阴、阳离子的个数比为1:1 |

 .
.