题目内容
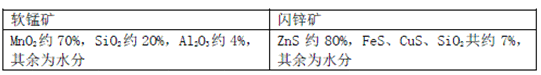
【题目】某地有软锰矿和闪锌矿两座矿山,它们的组成(质量分数)如下:
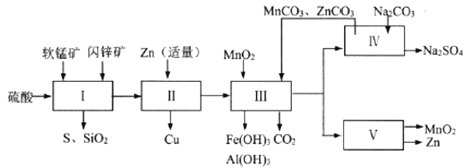
科研人员开发了综合利用这两种资源的同槽酸浸工艺,工艺流程如下图所示。
请回答下列问题。
(1)流程I所得滤液中含有MgSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2(SO4)3等,则流程I中被氧化的物质有_______种。
(2)流程II中反应的离子方程式为_____________。
(3)氢氧化物开始沉淀的pH如下表:
氢氧化物 | Fe(0H)3 | Al(0H)3 | Fe(0H)2 |
开始沉淀pH | 1.5 | 3.3 | 7.6 |
①流程III中MnO2的作用是将Fe2+氧化成Fe3+,不直接生成Fe(OH)3沉淀的原因是_________。
②MnCO3和ZnCO3的作用是______________。
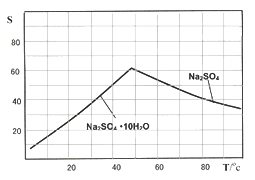
(4)下图是Na2SO4和Na2SO4·10H2O的溶解度(g/100g水)曲线,又知MnCO3和ZnSO4的溶解度随温度的升高而增大,则流程IV得到Na2SO4固体的操作是:将分离出MnCO3和ZnCO3后的滤液升温结晶、趁热过滤、_____、干燥,要“趁热”过滤的原因是:______________。
(5)本工艺所用的原料除软锰矿、闪锌矿、硫酸外还需要购买的原料是_______。
(6)流程V的反应为:MnSO4+ZnSO4+2H2O ![]() MnO2+Zn+2H2SO4,写出阳极反应式________。
MnO2+Zn+2H2SO4,写出阳极反应式________。
(7)MnO2和Zn可按物质的量之比1 : 1 生产锌-锰干电池,则从主产MnO2和Zn的角度计算,所用软锰矿和闪锌矿的质量比大约是__________。
【答案】 3 Zn+2Fe3+=2Fe2++Zn2+、Zn+Cu2+=Cu+Zn2+ 当Fe2+完全沉淀时碱过量,得不到Al(OH)3沉淀 调节溶液的pH,使Fe3+和Al3+生成沉淀 洗涤 尽量减少Na2SO4的溶解量 Na2CO3 Mn2+-2e-+2H2O=MnO2+4H+ 1.025
【解析】依据流程图分析可知,流程Ⅰ中软锰矿和闪锌矿在硫酸溶液发生反应生成二氧化硫气体,过滤得沉淀硫和二氧化硅,滤液中含有MgSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2(SO4)3等,流程Ⅱ中加入锌,将铁离子还原成亚铁离子,铜离子被还原成铜单质,过滤得到铜。流程Ⅲ中,加入MnO2将亚铁离子氧化成铁离子同时消耗酸而得到氢氧化铁和氢氧化铝沉淀,滤液中含有硫酸锰和硫酸锌,流程Ⅳ为滤液中加入碳酸钠得碳酸锰、碳酸锌可循环利用,滤液为硫酸钠溶液,流程Ⅴ为电解硫酸锰和硫酸锌混合溶液可得二氧化锰和锌,则(1)流程Ⅰ中软锰矿和闪锌矿在硫酸溶液发生反应生成二氧化硫气体,过滤得沉淀硫和二氧化硅,滤液中含有MgSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2(SO4)3等,其中FeS、CuS、ZnS中硫元素及铁元素化合价都升高,所以被氧化的物质有三种;(2)流程Ⅱ中加入锌,将铁离子还原成亚铁离子,铜离子被还原成铜单质,反应的离子方程式为Zn+2Fe3+=2Fe2++Zn2+、Zn+Cu2+=Cu+Zn2+;(3)①图表数据可知,亚铁离子沉淀完全的pH为7.6,而铁离子沉淀完全的pH为1.5,要将亚铁离子完全沉淀,碱需要过量,此时生成的氢氧化铝会溶解,因此必须把亚铁离子氧化成铁离子,使铁元素能全部沉淀;②要测定铁离子和铝离子,需要调节pH,又因为不能引入新杂志,所以MnCO3和ZnCO3的作用是调节溶液的pH,使Fe3+和Al3+生成沉淀;(4)图象分析可知温度高时析出硫酸钠,温度低时析出硫酸钠结晶水合物晶体,所以需要趁热过滤,尽量减少Na2SO4的溶解量;洗涤晶体时用乙醇洗涤避免形成结晶水合物;(5)由于碳酸钠在反应中被消耗,且在后续反应中不能产生,因此还需要购买的原料是碳酸钠;(6)流程图中得到产物为二氧化锰和锌分析,得到锌是锌离子在阴极得到电子析出;二氧化锰是在阳极锰离子失电子生成,电极反应为Mn2+-2e-+2H2O=MnO2+4H+;(7)据反应MnSO4+ZnSO4+2H2O=MnO2+Zn+2H2SO4可知MnO2、Zn的物质的量之比为1:1,故可设软锰矿、闪锌矿的质量分别为x、y,得0.7x/87:0.8y/97=1:1,故x:y=1.025.




