题目内容
【题目】下列有关热化学方程式的叙述正确的是
A. 己知2H2(g)+O2(g)=2H2O(g) △H=-483.6 kJ/mol,则H2的标准燃烧热为-241.8 kJ/mol
B. 已知C(石墨,s)==C(金刚石,s) △H>0,则金刚石比石墨稳定
C. 含20.0gNaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热置,则该反应的热化学方程式为:NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H=-57.4kJ/mol
D. 已知 2SO2(g)+O2(g) ![]() 2SO3(g) △H=-QkJ·mol-1(Q>0),则将2mol SO2(g)和lOmol O2(g)置于一密闭容器中充分反应后放出QkJ的热量
2SO3(g) △H=-QkJ·mol-1(Q>0),则将2mol SO2(g)和lOmol O2(g)置于一密闭容器中充分反应后放出QkJ的热量
【答案】C
【解析】A、燃烧热是1mol可燃物完全燃烧生成稳定的氧化物所释放的热量,水应为液态,故A错误;B、△H>0说明此反应是吸热反应,即金刚石的能量大于石墨,物质能量越低,越稳定,即石墨比金刚石稳定,故B错误;C、1mol氢氧化钠参与放出热量为28.7/0.5kJ=57.4kJ,故C正确;D、此反应是可逆反应,不能完全进行到底,放出的热量小于Q,故D错误。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
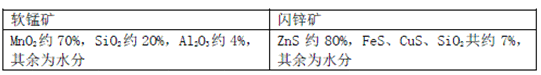
小学生10分钟应用题系列答案【题目】某地有软锰矿和闪锌矿两座矿山,它们的组成(质量分数)如下:
科研人员开发了综合利用这两种资源的同槽酸浸工艺,工艺流程如下图所示。
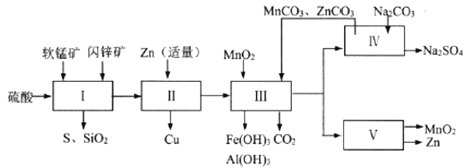
请回答下列问题。
(1)流程I所得滤液中含有MgSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2(SO4)3等,则流程I中被氧化的物质有_______种。
(2)流程II中反应的离子方程式为_____________。
(3)氢氧化物开始沉淀的pH如下表:
氢氧化物 | Fe(0H)3 | Al(0H)3 | Fe(0H)2 |
开始沉淀pH | 1.5 | 3.3 | 7.6 |
①流程III中MnO2的作用是将Fe2+氧化成Fe3+,不直接生成Fe(OH)3沉淀的原因是_________。
②MnCO3和ZnCO3的作用是______________。
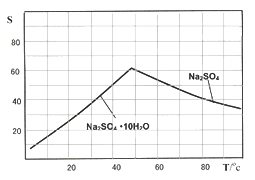
(4)下图是Na2SO4和Na2SO4·10H2O的溶解度(g/100g水)曲线,又知MnCO3和ZnSO4的溶解度随温度的升高而增大,则流程IV得到Na2SO4固体的操作是:将分离出MnCO3和ZnCO3后的滤液升温结晶、趁热过滤、_____、干燥,要“趁热”过滤的原因是:______________。
(5)本工艺所用的原料除软锰矿、闪锌矿、硫酸外还需要购买的原料是_______。
(6)流程V的反应为:MnSO4+ZnSO4+2H2O ![]() MnO2+Zn+2H2SO4,写出阳极反应式________。
MnO2+Zn+2H2SO4,写出阳极反应式________。
(7)MnO2和Zn可按物质的量之比1 : 1 生产锌-锰干电池,则从主产MnO2和Zn的角度计算,所用软锰矿和闪锌矿的质量比大约是__________。