题目内容
【题目】药用有机化合物A(C8H8O2)为一种无色液体。从A出发可发生如图所示的一系列反应。

则下列说法正确的是( )
A.根据D和浓溴水反应生成白色沉淀可推知D为三溴苯酚
B.G的同分异构体中属于酯且能发生银镜反应的只有一种
C.上述各物质中能发生水解反应的有A、B、D、G
D.A的结构简式为
【答案】D
【解析】
试题分析:A、A的不饱和度=![]() =5,B能和二氧化碳反应生成D,D能和溴水发生取代反应生成白色沉淀,说明D中含有酚羟基,所以A中含有苯环,因为A的不饱和度是5,则A中含有一个不饱和键;A能和氢氧化钠的水溶液发生水解反应生成B和C,则A中含有酯基,C酸化后生成E,E是羧酸,E和乙醇发生酯化反应生成G,G的分子式为C4H8O2,根据原子守恒知,E的分子式为C2H4O2,则E的结构简式为CH3COOH,C为CH3COONa,G的结构简式为CH3COOCH2CH3,根据原子守恒知,D的分子式为C6H6O,则D结构简式为:
=5,B能和二氧化碳反应生成D,D能和溴水发生取代反应生成白色沉淀,说明D中含有酚羟基,所以A中含有苯环,因为A的不饱和度是5,则A中含有一个不饱和键;A能和氢氧化钠的水溶液发生水解反应生成B和C,则A中含有酯基,C酸化后生成E,E是羧酸,E和乙醇发生酯化反应生成G,G的分子式为C4H8O2,根据原子守恒知,E的分子式为C2H4O2,则E的结构简式为CH3COOH,C为CH3COONa,G的结构简式为CH3COOCH2CH3,根据原子守恒知,D的分子式为C6H6O,则D结构简式为:![]() ,B为
,B为![]() ,F为
,F为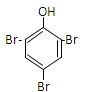 ,则A的结构简式为:
,则A的结构简式为:![]() ,则A不正确;B、G的同分异构体中属于酯且能发生银镜反应的应该是甲酸形成的酯类,则相应的醇是丙醇,丙醇有2种,B不正确;C、上述各物质中能发生水解反应的有A、B、C、D、G,C不正确;D、A的结构简式为
,则A不正确;B、G的同分异构体中属于酯且能发生银镜反应的应该是甲酸形成的酯类,则相应的醇是丙醇,丙醇有2种,B不正确;C、上述各物质中能发生水解反应的有A、B、C、D、G,C不正确;D、A的结构简式为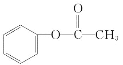 ,D正确,答案选D。
,D正确,答案选D。

 名校课堂系列答案
名校课堂系列答案【题目】某地有软锰矿和闪锌矿两座矿山,它们的组成(质量分数)如下:
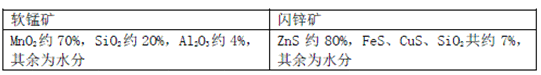
科研人员开发了综合利用这两种资源的同槽酸浸工艺,工艺流程如下图所示。
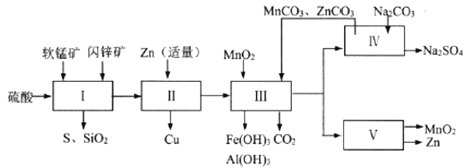
请回答下列问题。
(1)流程I所得滤液中含有MgSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2(SO4)3等,则流程I中被氧化的物质有_______种。
(2)流程II中反应的离子方程式为_____________。
(3)氢氧化物开始沉淀的pH如下表:
氢氧化物 | Fe(0H)3 | Al(0H)3 | Fe(0H)2 |
开始沉淀pH | 1.5 | 3.3 | 7.6 |
①流程III中MnO2的作用是将Fe2+氧化成Fe3+,不直接生成Fe(OH)3沉淀的原因是_________。
②MnCO3和ZnCO3的作用是______________。
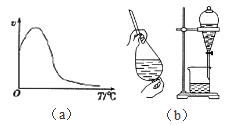
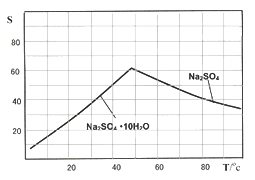
(4)下图是Na2SO4和Na2SO4·10H2O的溶解度(g/100g水)曲线,又知MnCO3和ZnSO4的溶解度随温度的升高而增大,则流程IV得到Na2SO4固体的操作是:将分离出MnCO3和ZnCO3后的滤液升温结晶、趁热过滤、_____、干燥,要“趁热”过滤的原因是:______________。
(5)本工艺所用的原料除软锰矿、闪锌矿、硫酸外还需要购买的原料是_______。
(6)流程V的反应为:MnSO4+ZnSO4+2H2O ![]() MnO2+Zn+2H2SO4,写出阳极反应式________。
MnO2+Zn+2H2SO4,写出阳极反应式________。
(7)MnO2和Zn可按物质的量之比1 : 1 生产锌-锰干电池,则从主产MnO2和Zn的角度计算,所用软锰矿和闪锌矿的质量比大约是__________。