题目内容
10.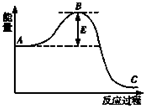 工业合成氨N2+3H2?2NH3反应过程中的能量变化如图所示,据图回答下列问题:
工业合成氨N2+3H2?2NH3反应过程中的能量变化如图所示,据图回答下列问题:(1)该反应通常用活性铁作催化剂,加活性铁会使图中B点升高还是降低降低,理由是催化剂改变了反应的历程使活化能E降低.
(2)该反应的平衡常数表达式为:K=$\frac{c{\;}^{2}(NH{\;}_{3})}{c(N{\;}_{2})c{\;}^{3}(H{\;}_{2})}$,当浓度商Qc<K(填“<”、“>”或“=”)时,反应向右进行.
(3)450℃时该反应的平衡常数>500℃时的平衡常数(填“<”、“>”或“=”).
(4)一定条件下的密闭容器中,该反应达到平衡,要提高H2的转化率,可以采取的合理措施有ce(填字母序号).
a.高温高压
b.加入催化剂
c.增加N2的浓度
d.增加H2的浓度
e.分离出NH3.
分析 (1)催化剂是通过降低反应的活化能来加快化学反应速率;
(2)化学平衡常数是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值以及Q和K的大小关系来回答;
(3)对于放热反应,温度降低,平衡正向移动,平衡常数增大;
(4)根据影响化学平衡移动的因素知识来回答判断.
解答 解:(1)催化剂是通过降低反应的活化能来加快化学反应速率,所以加活性铁会使图中B点降低,故答案为:降低;催化剂改变了反应的历程使活化能E降低;
(2)化学平衡常数是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,所以合成氨的平衡常数表达式K=$\frac{c{\;}^{2}(NH{\;}_{3})}{c(N{\;}_{2})c{\;}^{3}(H{\;}_{2})}$;根据K和Q的关系,当浓度商Q<K时,反应向右进行,直到达到平衡状态;
故答案为:$\frac{c{\;}^{2}(NH{\;}_{3})}{c(N{\;}_{2})c{\;}^{3}(H{\;}_{2})}$;<;
(3)合成氨的反应是放热反应,对于放热反应,温度降低,平衡正向移动,平衡常数增大,故答案为:>;
(4)一定条件下的密闭容器中,该反应达到平衡,要提高H2的转化率,即让化学平衡正向进行即可,一般不考虑加压,可以增加反应物N2的浓度、分离出NH3(减小生成物的浓度),高温条件会使平衡向左进行,加入催化剂不会改变反应物的转化率,增加H2的浓度会使得氢气的转化率减小;
故答案为:ce.
点评 本题考查较为综合,涉及化学平衡的移动,化学反应中能量变化、平衡常数的计算,题目难度中等,注意把握平衡常数的意义.

 阅读快车系列答案
阅读快车系列答案| A. | 1.0 mol•L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- | |
| B. | Kw=1.01×10-14的某无色溶液:NH4+、K+、AlO2-、Cl- | |
| C. | 与铝反应产生大量氢气的溶液:Na+、Ba2+、HCO3-、NO3- | |
| D. | 由水电离出来的c(H+)=1.0×10-13 mol•L-1的溶液:K+、Na+、NO3-、Cl- |
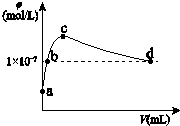 常温下,向1L pH=10的 NaOH溶液中持续通入CO2.通入的CO2的体积(V)与溶液中水电离出的OH-离子浓度(φ)的关系如图所示.下列叙述不正确的是( )
常温下,向1L pH=10的 NaOH溶液中持续通入CO2.通入的CO2的体积(V)与溶液中水电离出的OH-离子浓度(φ)的关系如图所示.下列叙述不正确的是( )| A. | a点溶液中:水电离出的c(H+)=1×10-10mol/L | |
| B. | b点溶液中:c(H+)=1×10-7mol/L | |
| C. | c点溶液中:c(Na+)>c(CO32-)>c(HCO3-) | |
| D. | d点溶液中:c(Na+)=2c(CO32-)+c(HCO3-) |
| A. | 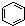 和 和 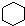 均是芳香烃, 均是芳香烃,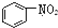 既是芳香烃又是芳香化合物 既是芳香烃又是芳香化合物 | |
| B. | 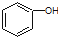 和 和 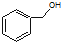 分子组成相差一个-CH2-,因此是同系物关系 分子组成相差一个-CH2-,因此是同系物关系 | |
| C. | 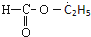 含有醛基,所以属于醛类 含有醛基,所以属于醛类 | |
| D. | 分子式为C4H10O的物质,可能属于醇类或醚类 |
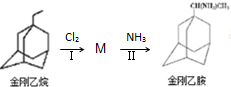
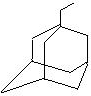 ,如金刚乙烷表示为R-CH2CH3);
,如金刚乙烷表示为R-CH2CH3);
 .
. .
.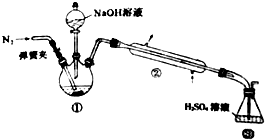 某小组以废铁屑、稀硫酸、饱和(NH4)2 SO4溶液为原料,经过一系列反应和操作后,合成了浅蓝绿色晶体X,为确定其组成,进行如下实验:
某小组以废铁屑、稀硫酸、饱和(NH4)2 SO4溶液为原料,经过一系列反应和操作后,合成了浅蓝绿色晶体X,为确定其组成,进行如下实验: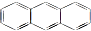 与苯炔(
与苯炔( )反应生成化合物X(立体对称图形),如图所示:
)反应生成化合物X(立体对称图形),如图所示: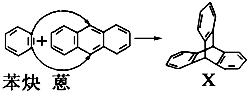
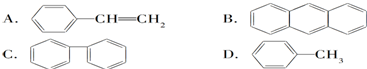
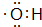 ;
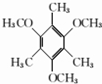
; 的系统命名为3-甲基戊烷.
的系统命名为3-甲基戊烷. .
.