题目内容
11.某温度下,向pH=6的纯水中加入一定量的氢氯酸,保持温度不变,测得溶液的pH=3,对于该溶液,下列叙述中不正确的是( )| A. | pH=6的纯水呈中性 | |
| B. | 该溶液的浓度c(HCl)=0.001 mol•L-1 | |
| C. | 该溶液中水电离产生的c(H+)=10-9 mol•L-1 | |
| D. | 该温度下,加入等体积的pH=11NaOH溶液,即可恰好完全中和 |
分析 A、纯水是中性的,pH=6是在高于常温下的温度水的电离分析;
B、该温度下的pH=6,可知离子积=10-12,加入一定量的盐酸后溶液中的氢离子浓度依据离子积计算;
C、依据溶液pH=3,结合水的离子积计算判断;
D、依据酸碱中和反应氢氧根离子和氢离子等物质的量反应分析计算.
解答 解:A、某温度下,纯水的pH=6,水中的氢氧根离子浓度和氢离子浓度相同,所以呈中性,故A正确;
B、向pH=6的纯水中加入一定量的盐酸,保持温度不变,测得溶液的pH=3,依据该温度下的离子积c(H+)×c(OH-)=10-12,得到溶液的浓度c(HCl)=0.001mol•L-1,故B正确;
C、该温度下的离子积c(H+)c(OH-)=10-12,该溶液中水电离产生的c(H+)=$\frac{1{0}^{-12}}{1{0}^{-3}}$=10-9mol•L-1,故C正确;
D、该温度下加入等体积pH=11的NaOH溶液,c(OH-)=$\frac{1{0}^{-12}}{1{0}^{-11}}$=0.1mol/L;盐酸溶液中c(H+)=10-3mol/L,等体积混合反应后,氢氧根离子过量,溶液呈碱性,不是恰好完全反应,故D错误;故选D.
点评 本题主要考查了水的电离,一定温度下,水的离子积是常数,此数值是温度的函数,关键是依据pH=6的纯水计算出离子积为10-12,难度不大.

练习册系列答案
相关题目
2.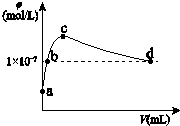 常温下,向1L pH=10的 NaOH溶液中持续通入CO2.通入的CO2的体积(V)与溶液中水电离出的OH-离子浓度(φ)的关系如图所示.下列叙述不正确的是( )
常温下,向1L pH=10的 NaOH溶液中持续通入CO2.通入的CO2的体积(V)与溶液中水电离出的OH-离子浓度(φ)的关系如图所示.下列叙述不正确的是( )
 常温下,向1L pH=10的 NaOH溶液中持续通入CO2.通入的CO2的体积(V)与溶液中水电离出的OH-离子浓度(φ)的关系如图所示.下列叙述不正确的是( )
常温下,向1L pH=10的 NaOH溶液中持续通入CO2.通入的CO2的体积(V)与溶液中水电离出的OH-离子浓度(φ)的关系如图所示.下列叙述不正确的是( )| A. | a点溶液中:水电离出的c(H+)=1×10-10mol/L | |
| B. | b点溶液中:c(H+)=1×10-7mol/L | |
| C. | c点溶液中:c(Na+)>c(CO32-)>c(HCO3-) | |
| D. | d点溶液中:c(Na+)=2c(CO32-)+c(HCO3-) |
6.下列分子中所有原子一定处于同一平面的是( )
| A. | CH3CH2CH=CH2 | B. | CH2=CH-CH=CH2 | C. | C6H5-C≡CH | D. | CH3CH=CH2 |
3.某气态烃0.5mol能与1mol HCl完全加成,加成后产物分子中的氢原子又可被3mol Cl2完全取代,则此气态烃可能是( )
| A. | CH3C≡CCH3 | B. | CH2=CH2 | C. | CH≡CCH3 | D. | CH2=CHCH3 |
20.下列叙述正确的是( )
| A. | 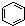 和 和 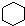 均是芳香烃, 均是芳香烃,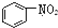 既是芳香烃又是芳香化合物 既是芳香烃又是芳香化合物 | |
| B. | 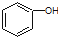 和 和 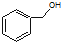 分子组成相差一个-CH2-,因此是同系物关系 分子组成相差一个-CH2-,因此是同系物关系 | |
| C. | 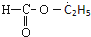 含有醛基,所以属于醛类 含有醛基,所以属于醛类 | |
| D. | 分子式为C4H10O的物质,可能属于醇类或醚类 |
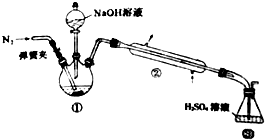 某小组以废铁屑、稀硫酸、饱和(NH4)2 SO4溶液为原料,经过一系列反应和操作后,合成了浅蓝绿色晶体X,为确定其组成,进行如下实验:
某小组以废铁屑、稀硫酸、饱和(NH4)2 SO4溶液为原料,经过一系列反应和操作后,合成了浅蓝绿色晶体X,为确定其组成,进行如下实验: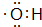 ;
; 的系统命名为3-甲基戊烷.
的系统命名为3-甲基戊烷. .
.
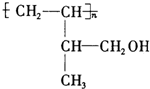 .
.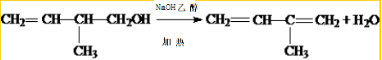 .
.