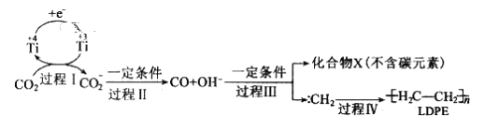
题目内容
【题目】铝镁合金已成为飞机制造.化工生产等行业的重要材料。研究性学习小组的同学,为测定某含镁3%-5%的镁铝合金(不含其它元素)中镁的质量分数,设计下列如下实验方案进行探究。填写下列空白:
(方案)将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。
(1)实验中发生反应的化学方程式是___________________________________________。
(2)用___________称取5.400 g铝镁合金粉末样品,溶于V mL 2.0 mol/L NaOH溶液中,为使其反应完全,则NaOH溶液的体积V≥________mL。
(3)__________、洗涤、__________、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将__________(填“偏高”“偏低”或“无影响”)
【答案】![]() 电子天平 97 过滤 烘干 偏高
电子天平 97 过滤 烘干 偏高
【解析】
铝为两性金属,能与氢氧化钠反应,镁在碱性环境下不反应。通过计算产生气体的量计算铝的质量,实验过程中应以镁的最小质量分数估计氢氧化钠的用量。
(1)实验中发生反应的化学方程式是![]() ;
;
(2)数值为小数点后三位,托盘天平只能估读到小数点后二位,精确称量用电子天平称取铝镁合金粉末样品,溶于V mL 2.0 mol/L NaOH溶液中,为使其反应完全,假设5.400g中含有镁3%,则铝的质量为5.238g,需要氢氧化钠0.194mol,体积为97ml,NaOH溶液的体积V≥97ml
(3)反应之后,经过过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,镁表面会附着少量的偏铝酸钠等物质,导致测得镁的质量分数将偏高。

练习册系列答案
相关题目