题目内容
【题目】研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO2可以被NaOH溶液捕获。若所得溶液c(HCO3-):c(CO32-)=2:1,溶液中由水电离出的c(H+)=__。(室温下,H2CO3的K1=4×10-7;K2=5×10-11)
(2)CO2和H2充入一定体积的密闭容器中,反应过程和在两种温度下CH3OH的物质的量随时间的变化如图所示。
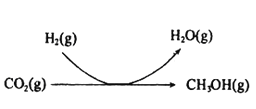
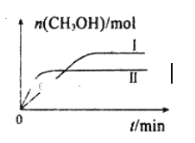
①已知图所示反应每消耗1molH2,热量变化是16.3kJ,则反应的热化学方程式为__。曲线I、Ⅱ对应的平衡常数大小关系为K1__K2(填“>”或“=”或“<”)。
②一定温度下,若此反应在恒压容器中进行,能判断该反应达到化学平衡状态的依据是__。
a.容器中压强不变
b.H2的体积分数不变
c.c(H2)=3c(CH3OH)
d.容器中密度不变
e.2个C=O断裂的同时有3个H—H断裂
③一定比例的合成气在装有催化剂的反应器中反应12小时,体系中甲醇的产率和催化剂的催化活性与温度的关系如图所示。
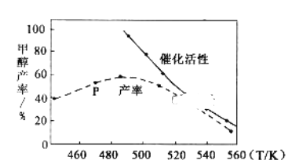
当温度为470K时,图中P点__(填“是”或“不是”)处于平衡状态。490K之后,甲醇产率下降的原因是__。
(3)用二氧化碳可合成低密度聚乙烯(LDPE)。常温常压下以纳米二氧化钛膜为工作电极,电解CO2,可制得LDPE,可能的机理如图所示。
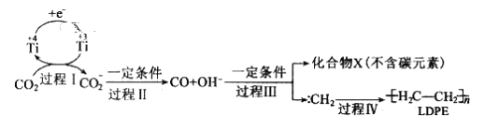
则过程I中阴极电极反应式__,工业上生产1.4×104g的LDPE,转移电子的物质的量为__。
【答案】10-4mol·L-1 CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-48.9kJ·mol-1 > bd 不是 反应为放热反应,升高温度,平衡逆向移动,且催化剂活性降低 CO2+e-=CO2- 6×103mol
CH3OH(g)+H2O(g) ΔH=-48.9kJ·mol-1 > bd 不是 反应为放热反应,升高温度,平衡逆向移动,且催化剂活性降低 CO2+e-=CO2- 6×103mol
【解析】
(1)所得溶液![]() ,由
,由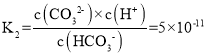 可知
可知![]() ,则c(OH)=10-4mol·L-1,则溶液中由水电离出的c(H+)=10-4mol·L-1;
,则c(OH)=10-4mol·L-1,则溶液中由水电离出的c(H+)=10-4mol·L-1;
故答案为: 10-4mol·L-1;
(2)①已知图1所示反应每消耗1molH2,热量变化是16.3KJ,涉及反应为CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),消耗3mol氢气,则热量变化为48.9kJ,曲线I、Ⅱ中Ⅱ温度较高,可知升高温度甲醇物质的量较小,应为放热反应,则热化学方程式为CO2(g)+3H2(g)
CH3OH(g)+H2O(g),消耗3mol氢气,则热量变化为48.9kJ,曲线I、Ⅱ中Ⅱ温度较高,可知升高温度甲醇物质的量较小,应为放热反应,则热化学方程式为CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H=-48.9kJ/mol,升高温度,平衡逆向移动,则平衡常数减小,K1>K2;
CH3OH(g)+H2O(g) △H=-48.9kJ/mol,升高温度,平衡逆向移动,则平衡常数减小,K1>K2;
故答案为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-48.9kJ·mol-1;>;
CH3OH(g)+H2O(g) ΔH=-48.9kJ·mol-1;>;
②a.反应在恒压条件下进行,无论是否达到平衡,容器中压强都不变,故a错误;b.H2的体积分数不变,可说明达到平衡状态,故b正确;c.平衡常数未知,且不能确定反应物转化的程度,c(H2)=3c(CH3OH)不能确定是否达到平衡状态,故c错误;d.反应前后体积不等,在恒压条件下,容器中密度不变,可说明达到平衡状态,故d正确;e.2个C=O断裂的同时有3个H-H断裂,都为正反应速率,不能说明正逆反应速率相等,故e错误;故答案为:bd;
③由于产率最高之前,未达到平衡状态,反应为放热反应,达到平衡之后,升高温度,平衡逆向移动,产率下降,且催化剂活性降低;
故答案为:不是;反应为放热反应,升高温度,平衡逆向移动,且催化剂活性降低;
(3)过程I中阴极电极发生还原反应生成![]() ,电极方程式为
,电极方程式为![]() ,由C原子守恒可知关系式为2nCO2~
,由C原子守恒可知关系式为2nCO2~![]() ,碳的化合价从+4变为-2,每个C原子得到6个电子,则2nCO2总共得到12n个电子,根据电荷守恒可得该电极反应式为:2nCO2+12e+12nH+=
,碳的化合价从+4变为-2,每个C原子得到6个电子,则2nCO2总共得到12n个电子,根据电荷守恒可得该电极反应式为:2nCO2+12e+12nH+=![]() +4nH2O,需要二氧化碳的物质的量为:
+4nH2O,需要二氧化碳的物质的量为:![]() ,则转移电子的物质的量为
,则转移电子的物质的量为![]() ;
;
故答案为:![]() ;6×103mol。
;6×103mol。

【题目】测定硫酸铜晶体(CuSO4XH2O )中X值的实验过程如下:
![]()
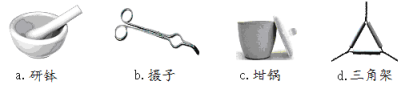
(1)下列是实验中用到的几种仪器,仪器与对应名称正确的是___________。
(2)“灼烧”时热源选用的是酒精灯而不是酒精喷灯,理由是_____________________;“冷却”放在_______________中(填仪器名称)。
(3) “恒重”操作的目的是_________________________________________________;
判断“恒重”的依据是_________________________________________________。
(4)下面是某学生实验的一次数据,请完成计算
坩埚质量 | 坩埚与晶体总质量 | 加热后坩埚与固体总质量 |
11.721g | 22.692g | 18.631g |
X=__________________;(精确到0.01),实验相对误差是_________________。(保留小数点后一位)
(5)这次实验中产生误差的原因可能是__________所造成的。
a.硫酸铜晶体中含有不挥发性杂质 b.在加热过程发现有黑色物质生成
c.加热时有晶体飞溅出来 d.加热失水后露置在空气中冷却