题目内容
【题目】下列说法中正确的是
A.1 mol H2 的体积是 22.4 L
B.O2 的摩尔质量是 48 g
C.标准状况下,22.4 L H2O 含有 6.02×1023 个 H2O
D.常温常压下,28g N2 与标准状况下 22.4 L CO2 含有相同的分子数
【答案】D
【解析】
A. 没有指明气体所处温度和压强,气体摩尔体积未知,无法计算1mol H2的体积,故A错误;
B. O2的摩尔质量为32g/mol,故B错误;
C. 标准状况下水不是气体,不能使用标准状况下气体摩尔体积计算水的物质的量,故C错误;
D. 28g N2的物质的量为![]() ,标准状况下22.4L CO2的物质的量为
,标准状况下22.4L CO2的物质的量为![]() ,根据N=nNA可知,二者含有分子数相同,故D正确;
,根据N=nNA可知,二者含有分子数相同,故D正确;
故选D。

【题目】下列实验“实验操作”与“结论”对应关系正确的是
选项 | 实验操作 | 结论 |
A | 向Fe(NO3)2溶液的试管中加入稀H2SO4 ,在管口观察到红棕色气体 | HNO3分解生成了NO2 |
B | 向沸水中逐滴加入1~2 mL FeCl3饱和溶液,煮沸至红褐色液体 | 制备Fe(OH)3胶体 |
C | 常温下,向饱和 | 说明常温下 |
D | 向纯碱中滴加足量浓盐酸,将产生的气体通入苯酚钠溶液,溶液变浑浊 | 酸性:盐酸>碳酸>苯酚 |
【题目】目前工业上有一种方法是用生产燃料甲醇。一定条件下发生反应,如图表示该反应过程中能量(单位kJ)的变化。
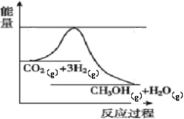
(1)已知拆开或形成![]() 化学键所吸收或放出的能量叫做该化学键的键能,单位
化学键所吸收或放出的能量叫做该化学键的键能,单位![]() 。根据表中的键能表示出图中的反应生成
。根据表中的键能表示出图中的反应生成![]() 时____________________(填“吸收”或“放出”)_____________________kJ热量。
时____________________(填“吸收”或“放出”)_____________________kJ热量。
化学键 |
|
|
|
|
|
键能( | a | b | c | d | e |
(2)在一固定容积的恒温密闭容器内进行上述反应,下列能说明该反应已经达到平衡状态的是_________(填序号)。
A ![]()
B 容器内气体压强保持不变
C ![]() 、
、![]() 、
、![]() 、
、![]() 四种气体物质的量浓度之比等于
四种气体物质的量浓度之比等于![]()
D 容器内气体密度保持不变
E ![]() 键断裂的同时
键断裂的同时![]() 键断裂
键断裂
(3)在体积为![]() 的密闭容器中,充入
的密闭容器中,充入![]() 和
和![]() ,测得
,测得![]() 和
和![]() 的浓度随时间变化如图所示。从反应开始到平衡,用氢气浓度变化表示的平均反应速率
的浓度随时间变化如图所示。从反应开始到平衡,用氢气浓度变化表示的平均反应速率![]() ____________________。容器内平衡时与起始时的压强之比为____________________。
____________________。容器内平衡时与起始时的压强之比为____________________。