题目内容
【题目】某实验小组同学在配制100mL0.1mol/L的NaOH溶液时,实验操作如下:
①往盛有NaOH固体的小烧杯中,加适量蒸馏水溶解。为加速溶解,可用_________(填仪器名称)搅拌。
②将①所得溶液冷却到室温后,小心转入___________(填仪器名称)中。
③计算需要NaOH固体的质量___________
④继续加蒸馏水至液面距刻度线1—2cm处,改用_____(填仪器名称)小心滴加蒸馏水至溶液凹液面最低点与刻度线相切。
⑤称量NaOH的质量,在托盘天平上,先称量一干燥而洁净的烧杯的质量。然后将NaOH放入烧杯,再称出它们的总质量。从总质量减去烧杯的质量便等于所需的NaOH的质量。
⑥用少量蒸馏水洗涤烧杯内壁和玻璃棒2—3次,洗涤液也都注入容量瓶,并轻轻摇匀。
⑦将容量瓶瓶塞塞紧,反复上下颠倒,摇匀。
请回答:
(1)正确的实验操作顺序为_________________(填序号)。
(2)取出20mL配制好的溶液,此溶液中NaOH的物质的量浓度为______。
(3)下列操作会使所配溶液物质的量浓度偏高的是______(填序号)。
A.容量瓶洗净后未经干燥处理
B.向容量瓶转移溶液时,有少量液体溅出
C.在烧杯内溶解NaOH后未等冷却就立即转移到容量瓶中
D.定容时俯视刻度线
E.定容时仰视刻度线
F.倒转容量瓶摇匀后,液面降至刻度线下,再加水至刻度。
【答案】玻璃棒 100mL容量瓶 0.4g 胶头滴管 ③⑤①②⑥④⑦ 0.1mol/L CD
【解析】
根据配制一定物质的量浓度的溶液的实验原理、实验步骤及所需仪器分析解答。根据![]() 进行误差分析。
进行误差分析。
①为加速溶解,可用玻璃棒搅拌;故答案为:玻璃棒;
②由于氢氧化钠固体溶解过程会放出热量,转移到容量瓶前必须冷却到室温,然后转移到100mL容量瓶中,故答案为: 100mL容量瓶;
③配制100mL 0.1mol/L的NaOH溶液中氢氧化钠的物质的量是0.1LL×0.1mol/L= 0.01mol,质量是0.01mol ×40g/mol=0.4g,故答案为:0.4g;
④加蒸馏水至液面距刻度线1-2cm处,改用胶头滴管定容;故答案为:胶头滴管;
(1)按照称量、溶解、冷却移液、洗涤、定容、摇匀的顺序,正确为:③⑤①②⑥④⑦,故答案为:③⑤①②⑥④⑦
(2)溶液时均匀的,所以取出溶液的浓度不变,故NaOH的物质的量浓度为:0.1mol/L;故答案为:0.1 mol/L;
(3) A.容量瓶洗净后未经干燥处理,对所配溶液浓度无影响,故A不选;
B.向容量瓶转移溶液时,有少量液体溅出,溶质损耗,导致溶液浓度偏低,故B不选;
C.在烧杯内溶解NaOH后未等冷却就立即转移到容量瓶中,当温度降低时,溶液体积减小,导致溶液浓度偏大,故C选;
D.定容时俯视刻度线,导致溶液的体积偏小,浓度偏大,故D选;
E.定容时仰视刻度线,导致溶液体积偏大,浓度偏小,故E不选;
F.倒转容量瓶摇匀后,液面降至刻度线下,再加水至刻度,使溶液浓度偏小,故答案为:CD。

 名校课堂系列答案
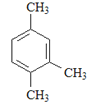
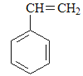
名校课堂系列答案【题目】烃是只含碳氢元素的一类有机物,关于下列烃的说法正确的是()
|
| CH3CH2CH2CH2CH2CH3 |
|
A.名称 1,3,4–三甲苯 | B.名称 2,2–二乙基丁烷 | C.所有碳原子可能处于同一平面 | D.所有碳原子一定处于同一平面 |
A. AB. BC. CD. D