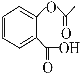
题目内容
【题目】下列实验“实验操作”与“结论”对应关系正确的是
选项 | 实验操作 | 结论 |
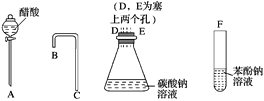
A | 向Fe(NO3)2溶液的试管中加入稀H2SO4 ,在管口观察到红棕色气体 | HNO3分解生成了NO2 |
B | 向沸水中逐滴加入1~2 mL FeCl3饱和溶液,煮沸至红褐色液体 | 制备Fe(OH)3胶体 |
C | 常温下,向饱和 | 说明常温下 |
D | 向纯碱中滴加足量浓盐酸,将产生的气体通入苯酚钠溶液,溶液变浑浊 | 酸性:盐酸>碳酸>苯酚 |
【答案】B
【解析】
试题A、硝酸根在酸性条件下氧化亚铁离子生成一氧化氮,一氧化氮和氧气反应生成二氧化氮,不是硝酸分解,错误,不选A;B、胶体制备的方法正确,选B;C、饱和碳酸钠中加入少量硫酸钡,部分硫酸钡因饱和碳酸钠溶液中高浓度的碳酸根转化为碳酸钡,不能证明KSP的大小,错误,不选C;D、向纯碱中加入盐酸产生二氧化碳,二氧化碳含有氯化氢气体,通入苯酚钠中产生苯酚,不能说明是氯化氢反应还是二氧化碳产生,不能比较酸性强弱,不选D。

【题目】下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0族 |
第二周期 | ① | ② | ③ | |||||
第三周期 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
第四周期 | ⑨ | ⑩ |
(1)在这些元素中,化学性质最不活泼的是:__(填元素符号),
(2)在最高价氧化物对应的水化物中,酸性最强的化合物的分子__,碱性最强的化合物的电子式是:__。
(3)用电子式表示元素④与⑥的化合物的形成过程:__。
(4)表示①与⑦的化合物的电子式__,该化合物是由__(填“极性”或“非极性”)键形成的。
(5)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是_(用化学式表示)。
(6)元素③的简单氢化物的结构式__,在常温下和元素⑦的单质反应的离子方程式__。