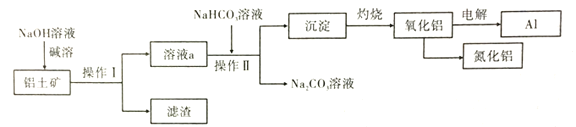
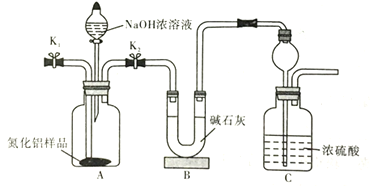
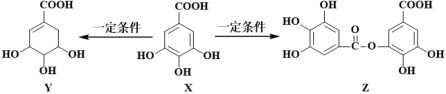
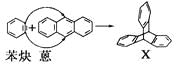
题目内容
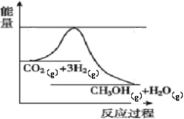
【题目】目前工业上有一种方法是用生产燃料甲醇。一定条件下发生反应,如图表示该反应过程中能量(单位kJ)的变化。
(1)已知拆开或形成![]() 化学键所吸收或放出的能量叫做该化学键的键能,单位
化学键所吸收或放出的能量叫做该化学键的键能,单位![]() 。根据表中的键能表示出图中的反应生成
。根据表中的键能表示出图中的反应生成![]() 时____________________(填“吸收”或“放出”)_____________________kJ热量。
时____________________(填“吸收”或“放出”)_____________________kJ热量。
化学键 |
|
|
|
|
|
键能( | a | b | c | d | e |
(2)在一固定容积的恒温密闭容器内进行上述反应,下列能说明该反应已经达到平衡状态的是_________(填序号)。
A ![]()
B 容器内气体压强保持不变
C ![]() 、
、![]() 、
、![]() 、
、![]() 四种气体物质的量浓度之比等于
四种气体物质的量浓度之比等于![]()
D 容器内气体密度保持不变
E ![]() 键断裂的同时
键断裂的同时![]() 键断裂
键断裂
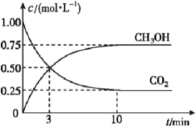
(3)在体积为![]() 的密闭容器中,充入
的密闭容器中,充入![]() 和
和![]() ,测得
,测得![]() 和
和![]() 的浓度随时间变化如图所示。从反应开始到平衡,用氢气浓度变化表示的平均反应速率
的浓度随时间变化如图所示。从反应开始到平衡,用氢气浓度变化表示的平均反应速率![]() ____________________。容器内平衡时与起始时的压强之比为____________________。
____________________。容器内平衡时与起始时的压强之比为____________________。
【答案】放出 2(-2a-3b+3c+d+2e) BE ![]() 5:8
5:8
【解析】
反应热等于反应物的键能总和与生成物的键能总和之差。根据化学平衡状态的特征判断可逆反应是否达到化学平衡状态。根据阿伏加德定律可知,在同温同体积条件下,气体的压强之比等于其物质的量之比。
(1)由图中信息可知,发生的反应为CO2(g)+3H2(g)=CH3OH(g)+H2O(g),该反应的反应物的总能量高于生成物的。根据表中的键能数据可以求出该反应的H=(2a+3b-3c-d-2e)![]() = -(-2a-3b+3c+d+2e)
= -(-2a-3b+3c+d+2e)![]() ,因此,生成
,因此,生成![]() 时放出2(-2a-3b+3c+d+2e)kJ热量。
时放出2(-2a-3b+3c+d+2e)kJ热量。
(2)A.![]() 说明正反应速率不等于逆反应速率,说明该反应未达平衡;
说明正反应速率不等于逆反应速率,说明该反应未达平衡;
B.反应前后的气体的分子数不同,故在反应过程中容器内的压强会发生变化,当容器内气体压强保持不变时,表明各组分的浓度保持不变,可以说明反应达到平衡状态;
C. ![]() 、
、![]() 、
、![]() 、
、![]() 四种气体物质的量浓度之比等于
四种气体物质的量浓度之比等于![]() ,不能说明其浓度之比保持这个比值不变,即不能说明各组分的浓度保持不变,不能说明达到平衡状态;
,不能说明其浓度之比保持这个比值不变,即不能说明各组分的浓度保持不变,不能说明达到平衡状态;
D. 反应过程中气体的总体积不变,气体的总质量也不变,故容器内气体密度始终保持不变,因此,容器内气体密度保持不变不能说明反应达到平衡状态;
E. ![]() 键断裂的同时
键断裂的同时![]() 键断裂可以说明正反应速率等于逆反应速率,反应达到平衡状态。
键断裂可以说明正反应速率等于逆反应速率,反应达到平衡状态。
综上所述,能说明该反应已经达到平衡状态的是BE。
(3)在体积为![]() 的密闭容器中,充入
的密闭容器中,充入![]() 和
和![]() ,测得
,测得![]() 和
和![]() 的浓度随时间变化如图所示。从反应开始到平衡,用氢气浓度变化表示的平均反应速率
的浓度随时间变化如图所示。从反应开始到平衡,用氢气浓度变化表示的平均反应速率![]() 3v(CO2)=3
3v(CO2)=3![]() 。容器内平衡时与起始时的压强之比等于气体的总物质的量之比,起始时气体的总物质的量4mol,平衡时气体的总物质的量为(0.25+0.253+0.752)mol=2.5mol,所以,容器内平衡时与起始时的压强之比为2.5:4=5:8。
。容器内平衡时与起始时的压强之比等于气体的总物质的量之比,起始时气体的总物质的量4mol,平衡时气体的总物质的量为(0.25+0.253+0.752)mol=2.5mol,所以,容器内平衡时与起始时的压强之比为2.5:4=5:8。

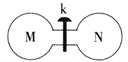
【题目】常温下,向如图所示的两个容积相同的刚性容器中分别充入气体M、N(如表所示),使两容器中压强相等。打开开关k,两容器中的气体充分混合后,恢复至常温,容器内的气体压强(固体影响忽略不计)由大到小的顺序正确的是 ( )
装置 | 编号 |
|
|
|
|
| M | NH3 | HI | NO | H2 |
N | Cl2 | Cl2 | O2 | O2 |
A.①=④>②=③ B.①=④>②>③
C.④>①>②>③D.①>④>②>③