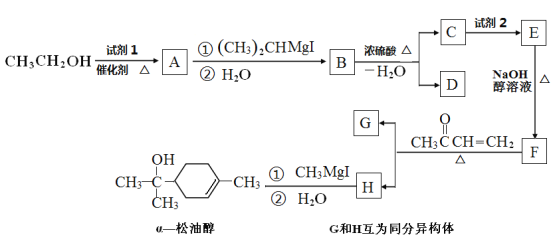
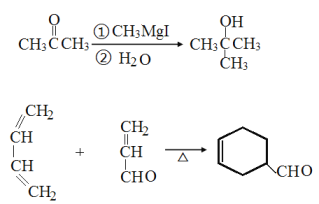
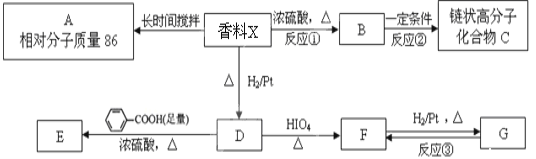
题目内容
【题目】现有200 mL MgCl2和AlCl3混合溶液,其中Mg2+浓度0.2mol/L、 Cl-浓度为1.3 mol/L。要使Mg2+转化成Mg(OH)2并使Mg2+、Al3+分离开来,至少需要4 mol/L NaOH溶液( )
A. 80mLB. 100mLC. 120mLD. 140mL
【答案】A
【解析】
根据MgCl2和AlCl3的混合溶液与碱的反应可知,要使Mg2+全部转化为沉淀分离出来,Al3+恰好转化为AlO2-,先利用电荷守恒来计算Al3+的浓度,再根据反应方程式计算即可。
MgCl2和AlCl3的混合溶液,其中Mg2+浓度为0.2molL-1,Cl-浓度为1.3molL-1,
设Al3+的浓度为x,由电荷守恒可知,
0.2mol/L×2+x×3=1.3mol/L×1,
解得x=0.3mol/L,
则Mg2+、Al3+物质的量分别为0.2L×0.2mol/L=0.04mol、0.2L×0.3mol/L=0.06mol,
由发生反应为MgCl2+2NaOH=Mg(OH)2↓+2NaCl
1 2
0.04mol 0.08mol
AlCl3+4NaOH=NaAlO2+3NaCl+2H2O,
1 4
0.06mol 0.24mol
使Mg2+全部转化为沉淀分离出来,消耗的NaOH的物质的量为0.08mol+0.24mol=0.32mol,
则需加4molL-1NaOH溶液的体积为![]() =0.08L=80mL,
=0.08L=80mL,
答案选A。

【题目】如图W、X、Y、Z为四种物质,若箭头表示能一步转化的常见反应,其中常温下能实现图示转化关系的是
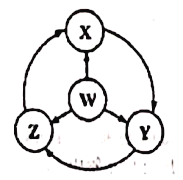
选项 | W | X | Y | Z |
A | Fe | Fe(OH)2 | FeCl3 | FeCl2 |
B | Na | Na202 | NaOH | NaCl |
C | S | SO2 | SO3 | H2SO4 |
D | A1 | AlCl3 | NaAlO2 | Al2(SO4)3 |
A. A B. B C. C D. D