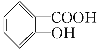
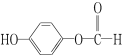
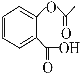
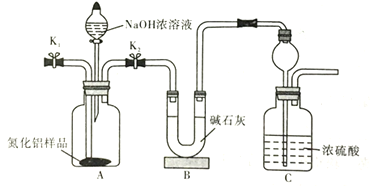
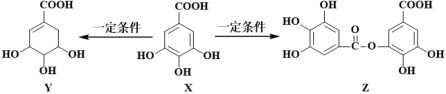
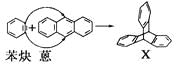
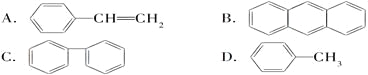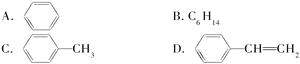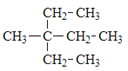题目内容
【题目】把 4.6g的Na放入足量的水中,至充分完全反应。 请写出计算过程:
(1)写出化学方程式,画出双线桥。_____________________
(2)该反应电子转移的物质的量。________________________
(3)生成的 H2 在标准状况下的体积。_____________________
(4)反应后溶液体积为2L,计算所得溶液的物质的量浓度。__________
【答案】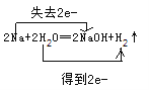 0.2mol × 1e- = 0.2mol 0.1mol × 22.4L/mol = 2.24L
0.2mol × 1e- = 0.2mol 0.1mol × 22.4L/mol = 2.24L ![]()
【解析】
(1)钠与水反应产生氢氧化钠和氢气,反应方程式为:2Na + 2H2O = 2NaOH + H2↑,双线桥表示为: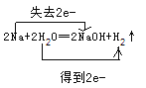 ,故答案为:
,故答案为: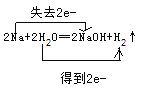 。
。
(2)由反应可知1molNa完全反应时转移电子的物质的量为1mol,则4.6g的Na的物质的量为0.2mol,转移电子的物质的量为0.2mol × 1e- = 0.2mol,故答案为:0.2mol × 1e- = 0.2mol。
(3)由反应可知2molNa产生1mol氢气,则0.2mol钠产生氢气的物质的量为0.1mol,标准状况下氢气的体积为:0.1mol × 22.4L/mol = 2.24L,故答案为:0.1mol × 22.4L/mol = 2.24L。
(4)反应所得溶液为氢氧化钠溶液,氢氧化钠的物质的量等于钠的物质的量,为0.2mol,所得溶液的物质的量浓度=![]() ,故答案为:
,故答案为:![]() 。
。

 期末冲刺100分创新金卷完全试卷系列答案
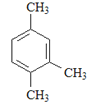
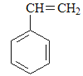
期末冲刺100分创新金卷完全试卷系列答案【题目】烃是只含碳氢元素的一类有机物,关于下列烃的说法正确的是()
|
| CH3CH2CH2CH2CH2CH3 |
|
A.名称 1,3,4–三甲苯 | B.名称 2,2–二乙基丁烷 | C.所有碳原子可能处于同一平面 | D.所有碳原子一定处于同一平面 |
A. AB. BC. CD. D
【题目】下表是元素周期表的一部分,阅读表格回答问题:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
一 | ① | |||||||
二 | ② | ③ | ④ | |||||
三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
(1)元素③的原子序数为___________,被选做相对原子质量标准的核素是___________(填核素符号);
(2)①与②、③、④、⑦、⑧形成的化合物中,最稳定的是___________(填化学式);表中所示元素最高价氧化物对应的水化物中酸性最强的是___________(填化学式);
(3)请画出元素④与⑤按原子个数比1︰1组成的淡黄色固体物质的化学式___________;
(4)请写出⑤的最高价氧化物对应水化物与⑥的单质反应的离子方程式___________。