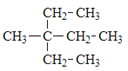题目内容
【题目】某种化合物(如图)由W、X、Y、Z四种短周期元素组成,其中W、Y、Z分别位于三个不同周期,Y核外最外层电子数是W核外最外层电子数的二倍;W、X、Y三种简单离子的核外电子排布相同。下列说法错误的是
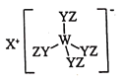
A.原子半径:![]()
B.简单离子的氧化性:![]()
C.X与Y、Y与Z均可形成具有漂白性的化合物
D.W与X的最高价氧化物的水化物可相互反应
【答案】A
【解析】
某种化合物由W、X、Y、Z四种短周期元素组成,由结构图可知X的简单离子为X+, W、X、Y三种简单离子的核外电子排布相同,结合Y核外最外层电子数是W核外最外层电子数的二倍,可知X为Na元素,Y为O元素,则W为Al元素;有W、Y、Z分别位于三个不同周期,可知Z为H元素,该化合物为Na[Al(OH)4];
A.同周期的主族元素核电荷数大,原子半径小,则原子半径Na>Al>S,S和O同主族,则原子半径S>O,氢原子是原子半径最小的原子,则原子半径:H<O<Al<Na,即Z<W<Y<X,故A错误;
B.金属越活泼,简单离子的氧化性的越弱,Na的金属性比Al强,则简单离子的氧化性:Al3+>Na+,故B正确;
C.Na2O2、H2O2均有强氧化性,具有漂白性,故C正确;
D.Al(OH)3能与NaOH溶液反应,即Al、Na的最高价氧化物的水化物可相互反应,故D正确;
故答案为A。

 名校课堂系列答案
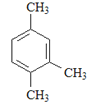
名校课堂系列答案【题目】烃是只含碳氢元素的一类有机物,关于下列烃的说法正确的是()
|
| CH3CH2CH2CH2CH2CH3 |
|
A.名称 1,3,4–三甲苯 | B.名称 2,2–二乙基丁烷 | C.所有碳原子可能处于同一平面 | D.所有碳原子一定处于同一平面 |
A. AB. BC. CD. D
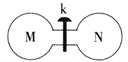
【题目】常温下,向如图所示的两个容积相同的刚性容器中分别充入气体M、N(如表所示),使两容器中压强相等。打开开关k,两容器中的气体充分混合后,恢复至常温,容器内的气体压强(固体影响忽略不计)由大到小的顺序正确的是 ( )
装置 | 编号 |
|
|
|
|
| M | NH3 | HI | NO | H2 |
N | Cl2 | Cl2 | O2 | O2 |
A.①=④>②=③ B.①=④>②>③
C.④>①>②>③D.①>④>②>③
【题目】三氯胺(![]() )是一种饮用水二级消毒剂,可由以下反应制备:Ⅰ.
)是一种饮用水二级消毒剂,可由以下反应制备:Ⅰ.![]()
![]() 。回答下列问题:
。回答下列问题:
(1)已知:Ⅱ.![]()
![]() Ⅲ.
Ⅲ.![]()
![]() ,则
,则![]() ________(用含
________(用含![]() 和
和![]() 的代数式表示)。
的代数式表示)。
(2)向容积均为2 L的甲、乙两个恒温密闭容器中分别加入![]() 和
和![]() ,发生反应Ⅰ,测得两容器中
,发生反应Ⅰ,测得两容器中![]() 随反应时间的变化情况如下表所示:
随反应时间的变化情况如下表所示:
时间/min | 0 | 40 | 80 | 120 | 160 |
容器甲( | 4.0 | 3.0 | 2.2 | 1.6 | 1.6 |
容器乙( | 4.0 | 2.9 | 2.0 | 2.0 | 2.0 |
①0~80 min内,容器甲中![]() ________。
________。
②反应Ⅰ的![]() ________0(填“>”或“<”),其原因为________________________。
________0(填“>”或“<”),其原因为________________________。
③关于反应Ⅰ,下列说法正确的是________(填选项字母)。
a.容器内![]() ,说明反应达到平衡状态
,说明反应达到平衡状态
b.容器内气体密度不变,说明反应达到平衡状态
c.达平衡后,加人一定量![]() ,平衡逆向移动
,平衡逆向移动
d.达平衡后,按原投料比再充入一定量反应物,平衡后![]() 的转化率增大
的转化率增大
④温度为![]() 时HCl(g)的平衡体积分数=________,该温度下,若改为初始体积为2 L的可变容器,平衡时容器中
时HCl(g)的平衡体积分数=________,该温度下,若改为初始体积为2 L的可变容器,平衡时容器中![]() ________(填“>”“=”或“<”)1.6 mol。
________(填“>”“=”或“<”)1.6 mol。
⑤温度为![]() 时,该反应的平衡常数
时,该反应的平衡常数![]() ________。
________。
【题目】下表是元素周期表的一部分,阅读表格回答问题:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
一 | ① | |||||||
二 | ② | ③ | ④ | |||||
三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
(1)元素③的原子序数为___________,被选做相对原子质量标准的核素是___________(填核素符号);
(2)①与②、③、④、⑦、⑧形成的化合物中,最稳定的是___________(填化学式);表中所示元素最高价氧化物对应的水化物中酸性最强的是___________(填化学式);
(3)请画出元素④与⑤按原子个数比1︰1组成的淡黄色固体物质的化学式___________;
(4)请写出⑤的最高价氧化物对应水化物与⑥的单质反应的离子方程式___________。
【题目】一定温度下,在3个体积均为1.0 L的恒容密闭容器中反应2H2(g)+CO(g)![]() CH3OH(g)达到平衡,下列说法正确的是( )
CH3OH(g)达到平衡,下列说法正确的是( )
容器 | 温度/K | 物质的起始浓度/mol·L-1 | 物质的平衡浓度/mol·L-1 | ||
c(H2) | c(CO) | c(CH3OH) | c(CH3OH) | ||
Ⅰ | 400 | 0.20 | 0.10 | 0 | 0.080 |
Ⅱ | 400 | 0.40 | 0.20 | 0 | |
Ⅲ | 500 | 0.20 | 0.10 | 0 | 0.025 |
A. 该反应的正反应放热
B. 达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大
C. 达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中c(H2)的两倍
D. 达到平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的大