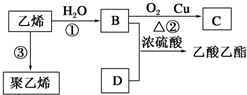
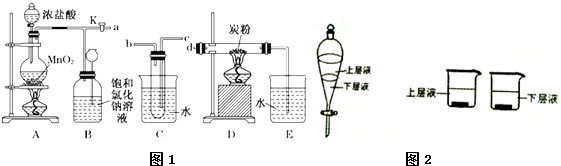
题目内容
20.运用化学反应原理研究部分单质及其化合物的反应有重要意义.(1)氨是氮循环过程中的重要物质,是氮肥工业的重要原料.氨的合成是目前普遍使用的人工固氮方法:N2(g)+3H2(g)?2NH3(g).请回答:
①已知:H-H键能为436kJ/mol,N≡N键能为945kJ/mol,N一H键能为391kJ/mol.由键能计算消耗1molN2时的△H=-93kJ/mol.
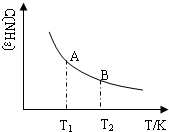
②若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡向左移动(填“向左”、“向右”或“不”); 氨气的平衡浓度随温度变化如图所示,当合成氨平衡体系温度由T1变化到T2时,KA>KB(填“>”、“<”或“=”).
③在25°C下,将a mol•L-1的氨水与b mol•L-1的盐酸等体积混合,反应后溶液中显中性,则c(NH4+)=c(Cl-)(填“>”、“<”或“=”);
用含a和b的代数式表示出氨水的电离平衡常数表达式10−7ba−b10−7ba−b.
(2)100℃时,若将0.100mol N2O4气体放入1L密闭容器中,发生反应N2O4?2NO2,c(N2O4)随时间的变化如表所示.回答下列问题:
| 时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4)/(mol•L-1) | 0.100 | 0.070 | 0.050 | 0.040 | 0.040 | 0.040 |
此温度下的化学平衡常数K为0.36.
②下列能说明该反应达到平衡状态的是BD.
A.2v(N2O4)=v(NO2) B.体系的颜色不再改变
C.混合气体的密度不再改变 D.混合气体的压强不再改变
③该反应达到平衡后,降温至50℃,c(N2O4)变为0.080mol•L-1,混合气体的颜色变浅(填“深”或“浅”),该反应的正反应为吸热(填“吸热”或“放热”)反应.
④该反应达平衡后,若只改变一个条件,达新平衡时,下列能使NO2的体积分数增大的是:B
A.充入一定量的NO2 B.增大容器的容积
C.分离出一定量的NO2 D.充入一定量的N2.
分析 (1)①反应物的总键能-生成物的总键能=反应热,据此计算该反应的反应热;
②恒压条件下向上述平衡体系中通入氦气,为保持恒压,体积增大,压强减小,平衡逆向进行;分析图象,反应为放热反应,温度升高,氨气浓度减小,平衡逆向进行,平衡常数减小;
③根据电荷守恒:c(H+)+c(NH4+)=c(OH-)+c(Cl-),现已知c(H+)=c(OH-),所以c(NH4+)=c(Cl-); Kb(NH3•H2O)=c(OH−)c(NH4+)c(NH3•H2O)c(OH−)c(NH4+)c(NH3∙H2O),c(OH-)=10-7mol•L-1,c(NH4+)=b2b2mol•L-1,c(NH3•H2O)=1212(a-b) mol•L-1;
(2)①由表可知,0~40s时间内N2O4的浓度由0.10mol/L减小为0.050mol/L,以此计算其反应速率,再利用反应速率之比等于化学计量数之比计算NO2的反应速率;平衡常数为生成物浓度幂之积与反应物浓度幂之积的比;
②根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
③降低温度平衡向放热反应移动;平衡时,c(N2O4)=0.040mol/L,降温至50℃,c(N2O4)变为0.080mol•L-1,说明该反应的正反应为吸热反应;
④依据化学平衡原理分析改变条件增大NO2的体积分数的选项;
解答 解:(1)①反应N2(g)+3H2(g)?2NH3(g)的反应热△H=945kJ•mol-1+3×436kJ•mol-1-2×3×391kJ•mol-1=-93kJ•mol-1,故热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-93kJ•mol-1;故答案为:-93kJ/mol;
②恒压条件下向上述平衡体系中通入氦气,为保持恒压,体积增大,压强减小,平衡逆向进行;分析图象,反应为放热反应,温度升高,氨气浓度减小,平衡逆向进行,平衡常数减小,KA>KB,故答案为:向左;>;
③氨气溶于水得到氨水.在25°C下,将a mol•L-1的氨水与b mol•L-1的盐酸等体积混合,反应后溶液中显中性,根据电荷守恒:c(H+)+c(NH4+)=c(OH-)+c(Cl-),现已知c(H+)=c(OH-),所以c(NH4+)=c(Cl-),c(OH-)=10-7mol•L-1,c(NH4+)=b2b2mol•L-1,c(NH3•H2O)=1212(a-b) mol•L-1,Kb(NH3•H2O)=)c(OH−)c(NH4+)c(NH3•H2O)c(OH−)c(NH4+)c(NH3∙H2O)=10−7ba−b10−7ba−b,
故答案为:=,10−7ba−b10−7ba−b;
(2)①由表可知,0~40s时间内N2O4的浓度由0.10mol/L减小为0.050mol/L,则其反应速率为V(N2O4)=△c△t△c△t=0.10mol/L−0.05mol/L40s0.10mol/L−0.05mol/L40s=0.00125mol/(L•s),由反应速率之比等于化学计量数之比,则NO2的反应速率为V(NO2)=0.00125mol/(L.s)×2=0.0025mol/(L.s),60S时,N2O4的浓度不再变化,说明已达平衡,平衡时,c(N2O4)=0.040mol/L,1L密闭容器n(N2O4)=0.040mol,反应消耗n(N2O4)=0.1mol-0.040mol=0.06mol,N2O4?2NO2,此时,n(NO2)=0.12mol,c(NO2)=0.12mol/L,
平衡常数为生成物浓度幂之积与反应物浓度幂之积的比,则K=c2(NO2)c(N2O4)c2(NO2)c(N2O4)=0.12×0.120.040.12×0.120.04=0.36,
故答案为:0.0025;0.36;
②N2O4(无色)?2NO2(红棕色)在1L密闭容器中进行,
A.2v(N2O4)=v(NO2),NO2的反应速率是N2O4的反应速率的2倍,未体现正与逆的关系,故A错误;
B.体系的颜色不再改变,说明二氧化氮的浓度不变,正逆反应速率相等,故B正确;
C.无论是否反应,体系的混合气体的总质量不变,密度不变,未体现正与逆的关系,故C错误;
D.该反应正反应为体积增大的反应,混合气体的压强不再改变,说明气体的物质的量不变,正逆反应速率相等,故D正确;
故答案为:BD;
③平衡时,c(N2O4)=0.040mol/L,降温至50℃,c(N2O4)变为0.080mol•L-1,N2O4(无色)?2NO2(红棕色)说明平衡逆向移动,所以混合气体的颜色变浅,降低温度平衡向放热反应方向移动,说明该反应的正反应为吸热反应,
故答案为:浅;吸热;
④N2O4(无色)?2NO2(红棕色)在1L密闭容器中进行,使NO2的体积分数增大,需平衡向正反应方向移动,
A.充入一定量的NO2,c(NO2)增大,平衡向逆反应方向移动,则NO2的体积分数减小,故A错误;
B.增大容器的容积,各组分浓度均减小,但平衡向体积增大的方向移动,即正向移动,NO2的体积分数增大,故B正确;
C.分离出一定量的NO2,平衡虽正向进行,但二氧化氮的浓度减小,则NO2的体积分数减小,故C错误;
D.充入一定量的N2,总压增大,气体分压不变,不会引起化学平衡的移动,二氧化氮浓度不变,故D错误;
故答案为:B.
点评 本题考查热化学方程式能量变化以及反应速率及平衡常数的计算以及化学平衡的有关知识,把握影响化学平衡移动的因素是解答的关键,题目难度中等.

 中考解读考点精练系列答案
中考解读考点精练系列答案| A. | 该灰黑色粉末用作抗氧化剂 | B. | 小袋中的原装粉末是Fe2O3 | ||
| C. | 小袋中可能装有活性铁粉 | D. | 该灰黑色粉末不可食用 |

(1)M与W(分子结构如图)相比,M的水溶性小,更利于Cu2+的萃取.M水溶性小的主要原因是M能形成分子内氢键,使溶解度减小.
(2)基态Cu2+的外围电子排布式为3d9,Cu2+等过渡元素水合离子是否有颜色与原子结构有关,且存在一定的规律.判断Sc3+、Zn2+的水合离子为无色的依据是3d轨道上没有未成对电子(3d轨道上电子为全空或全满).
| 离子 | Sc3+ | Ti3+ | Fe2+ | Cu2+ | Zn2+ |
| 颜色 | 无色 | 紫红色 | 浅绿色 | 蓝色 | 无色 |
| A. | 氯胺水解产物最初为羟胺(NH2OH)和HCl | |
| B. | 氯胺在一定条件下可与乙烯加成得H2NCH2CH2Cl | |
| C. | 氯胺的消毒原理与漂白粉相似 | |
| D. | 氯胺的电子式为 |
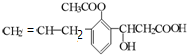 ,则此有机物可发生的反应类型有:①取代 ②加成 ③消去 ④酯化 ⑤水解 ⑥氧化 ⑦缩聚 ⑧中和 则( )
,则此有机物可发生的反应类型有:①取代 ②加成 ③消去 ④酯化 ⑤水解 ⑥氧化 ⑦缩聚 ⑧中和 则( )| A. | 除①⑥外均能 | B. | 除①⑦外均能 | C. | 除⑥⑦外均能 | D. | 以上反应均能 |
 氯乙烷跟化合物之间的转化如图所示:
氯乙烷跟化合物之间的转化如图所示: