题目内容
12.已知乙烯能发生以下转化:
(1)C中含官能团名称醛基;
(2)写出反应的化学方程式及反应类型:B与D反应的化学方程式CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O;反应类型:酯化反应(或取代反应).
分析 根据图可知:B为乙醇,C为乙醛,D为乙酸,
(1)乙醛中含有的官能团为醛基;
(2)B为乙醇,D为乙酸,乙醇和乙酸通过酯化反应生成乙酸乙酯,据此分析.
解答 解:根据图可知:B为乙醇,C为乙醛,D为乙酸,
(1)C为乙醛CH3CHO,乙醛中含有的官能团为醛基,故答案为:醛基;
(2)B为乙醇,D为乙酸,乙醇和乙酸通过酯化反应生成乙酸乙酯,化学方程式为CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,故答案为:CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O;酯化反应(或取代反应).
点评 本题主要考查了有机物的化学性质和化学方程式的书写,可以根据所学知识进行回答,难度不大.

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案
相关题目
2.下列化学用语正确的是( )
| A. | 聚丙烯结构简式: | B. | 四氯化碳的电子式为: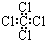 | ||
| C. | 丙烷分子的比例模型为: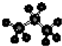 | D. | 2-乙基-1,3-丁二烯的键线式: |
3.燃料电池是利用燃料(如H2、CO、CH4等)跟氧气或空气反应,将化学能转化成电能的装置,电解质溶液是强碱.下面关于甲烷燃料电池的说法正确的是( )
| A. | 负极反应为:O2+2H2O+4e═4OH- | |
| B. | 负极反应为:CH4+10OH--8e═CO32-+7H2O | |
| C. | 放电时溶液中的阳离子向负极移动 | |
| D. | 随放电的进行,溶液的pH值不变 |
20.运用化学反应原理研究部分单质及其化合物的反应有重要意义.
(1)氨是氮循环过程中的重要物质,是氮肥工业的重要原料.氨的合成是目前普遍使用的人工固氮方法:N2(g)+3H2(g)?2NH3(g).请回答:
①已知:H-H键能为436kJ/mol,N≡N键能为945kJ/mol,N一H键能为391kJ/mol.由键能计算消耗1molN2时的△H=-93kJ/mol.
②若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡向左移动(填“向左”、“向右”或“不”); 氨气的平衡浓度随温度变化如图所示,当合成氨平衡体系温度由T1变化到T2时,KA>KB(填“>”、“<”或“=”).
③在25°C下,将a mol•L-1的氨水与b mol•L-1的盐酸等体积混合,反应后溶液中显中性,则c(NH4+)=c(Cl-)(填“>”、“<”或“=”);
用含a和b的代数式表示出氨水的电离平衡常数表达式$\frac{10{\;}^{-7}b}{a-b}$.
(2)100℃时,若将0.100mol N2O4气体放入1L密闭容器中,发生反应N2O4?2NO2,c(N2O4)随时间的变化如表所示.回答下列问题:
①在0~40s时段,化学反应速率v(NO2)为0.0025mol•L-1•s-1;
此温度下的化学平衡常数K为0.36.
②下列能说明该反应达到平衡状态的是BD.
A.2v(N2O4)=v(NO2) B.体系的颜色不再改变
C.混合气体的密度不再改变 D.混合气体的压强不再改变
③该反应达到平衡后,降温至50℃,c(N2O4)变为0.080mol•L-1,混合气体的颜色变浅(填“深”或“浅”),该反应的正反应为吸热(填“吸热”或“放热”)反应.
④该反应达平衡后,若只改变一个条件,达新平衡时,下列能使NO2的体积分数增大的是:B
A.充入一定量的NO2 B.增大容器的容积
C.分离出一定量的NO2 D.充入一定量的N2.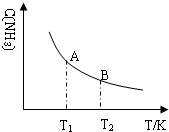
(1)氨是氮循环过程中的重要物质,是氮肥工业的重要原料.氨的合成是目前普遍使用的人工固氮方法:N2(g)+3H2(g)?2NH3(g).请回答:
①已知:H-H键能为436kJ/mol,N≡N键能为945kJ/mol,N一H键能为391kJ/mol.由键能计算消耗1molN2时的△H=-93kJ/mol.
②若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡向左移动(填“向左”、“向右”或“不”); 氨气的平衡浓度随温度变化如图所示,当合成氨平衡体系温度由T1变化到T2时,KA>KB(填“>”、“<”或“=”).
③在25°C下,将a mol•L-1的氨水与b mol•L-1的盐酸等体积混合,反应后溶液中显中性,则c(NH4+)=c(Cl-)(填“>”、“<”或“=”);
用含a和b的代数式表示出氨水的电离平衡常数表达式$\frac{10{\;}^{-7}b}{a-b}$.
(2)100℃时,若将0.100mol N2O4气体放入1L密闭容器中,发生反应N2O4?2NO2,c(N2O4)随时间的变化如表所示.回答下列问题:
| 时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4)/(mol•L-1) | 0.100 | 0.070 | 0.050 | 0.040 | 0.040 | 0.040 |
此温度下的化学平衡常数K为0.36.
②下列能说明该反应达到平衡状态的是BD.
A.2v(N2O4)=v(NO2) B.体系的颜色不再改变
C.混合气体的密度不再改变 D.混合气体的压强不再改变
③该反应达到平衡后,降温至50℃,c(N2O4)变为0.080mol•L-1,混合气体的颜色变浅(填“深”或“浅”),该反应的正反应为吸热(填“吸热”或“放热”)反应.
④该反应达平衡后,若只改变一个条件,达新平衡时,下列能使NO2的体积分数增大的是:B
A.充入一定量的NO2 B.增大容器的容积
C.分离出一定量的NO2 D.充入一定量的N2.

7.下列各组离子在指定条件下一定不能大量共存的是( )
| A. | 能使红色石蕊试纸变蓝的溶液中:Na+、K+、CO32-、NO3-、AlO2- | |
| B. | c(H+)=0.1 mol/L的溶液中:Cu2+、Al3+、SO42-、NO3- | |
| C. | 在加入铝粉后能产生氢气的溶液中:NH4+、Fe2+、SO42-、NO3- | |
| D. | 含大量OH-的溶液中:CO32-、Cl-、F-、K+ |
17.能说明醋酸是弱电解质的事实是( )
①用浓硫酸和醋酸钠固体共热可以制得醋酸,②醋酸钠水溶液呈碱性,
③可以用食醋清除水壶中的水垢,④pH=2的醋酸溶液稀释1000倍后的pH<5.
①用浓硫酸和醋酸钠固体共热可以制得醋酸,②醋酸钠水溶液呈碱性,
③可以用食醋清除水壶中的水垢,④pH=2的醋酸溶液稀释1000倍后的pH<5.
| A. | ①③④ | B. | ①② | C. | ②④ | D. | ② |
4.A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大.A与D同主族;C与E同主族;B、C同周期;B原子最外层电子数比其次外层电子数多2;B、A两元素的核电荷数之差等于它们的原子最外层电子数之和;F元素是同周期元素中原子半径最小的主族元素.A、B、C、D、E、F形成的化合物甲、乙、丙、丁、戊、己的组成如下表所示.
回答下列问题
(1)元素B的元素符号是:C化合物丙的电子式为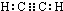 .化合物丁存在的化学键类型是离子键、非极性共价键.
.化合物丁存在的化学键类型是离子键、非极性共价键.
(2)化合物甲的沸点比戊高 (填“高”或“低”),B、C、D原子半径从大到小依次为Na>C>O(用元素符号)
(3)向含有0.2mol乙的水溶液中加入少量MnO2,使乙完全反应,发生转移的电子数为0.2NA (NA代表阿伏加德罗常数)
(4)A单质与C单质在KOH溶液中可以组成燃料电池,则正极发生的电极反应式为O2+2H2O+4e-=4OH-;放电一段时间KOH的物质的量不变(填“变大”“变小”“不变”)
(5)用电子式表示己的形成过程: .
.
| 化合物 | 甲 | 乙 | 丙 | 丁 | 戊 | 己 |
| 化学式 | A2C | A2C2 | B2A2 | D2C2 | A2E | DF |
(1)元素B的元素符号是:C化合物丙的电子式为
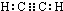 .化合物丁存在的化学键类型是离子键、非极性共价键.
.化合物丁存在的化学键类型是离子键、非极性共价键.(2)化合物甲的沸点比戊高 (填“高”或“低”),B、C、D原子半径从大到小依次为Na>C>O(用元素符号)
(3)向含有0.2mol乙的水溶液中加入少量MnO2,使乙完全反应,发生转移的电子数为0.2NA (NA代表阿伏加德罗常数)
(4)A单质与C单质在KOH溶液中可以组成燃料电池,则正极发生的电极反应式为O2+2H2O+4e-=4OH-;放电一段时间KOH的物质的量不变(填“变大”“变小”“不变”)
(5)用电子式表示己的形成过程:
 .
.
1.乙酸乙酯和丙酸的混合物中氧元素质量分数为30%,则氢元素的质量分数为( )
| A. | 40% | B. | 30% | C. | 10% | D. | 20% |
2.下列反应中属于吸热反应的是( )
| A. | 炸药爆炸 | B. | 食物因氧化而腐败 | ||
| C. | 氢氧化钠与盐酸反应 | D. | Ba(OH)2•8H2O与NH4Cl反应 |