题目内容
8.利用铜萃取剂M,通过如下反应实现铜离子的富集:
(1)M与W(分子结构如图)相比,M的水溶性小,更利于Cu2+的萃取.M水溶性小的主要原因是M能形成分子内氢键,使溶解度减小.
(2)基态Cu2+的外围电子排布式为3d9,Cu2+等过渡元素水合离子是否有颜色与原子结构有关,且存在一定的规律.判断Sc3+、Zn2+的水合离子为无色的依据是3d轨道上没有未成对电子(3d轨道上电子为全空或全满).
| 离子 | Sc3+ | Ti3+ | Fe2+ | Cu2+ | Zn2+ |
| 颜色 | 无色 | 紫红色 | 浅绿色 | 蓝色 | 无色 |
分析 (1)分子内氢键的存在,导致水溶性减小,据此解答即可;
(2)根据核外电子排布规律书写Cu原子的核外电子排布式,电子按能层高低进行失去,进而书写Cu2+的外围电子排布式;判断Sc3+、Zn2+离子的原子核外3d轨道上是否含有电子来判断是否有颜色.
解答 解:(1)由于M能形成分子内氢键,使溶解度减小,故答案为:M能形成分子内氢键,使溶解度减小;
(2)Cu原子的核外电子排布式为1s22s22p63s23p63d104s1,故Cu2+的外围电子排布式为3d9,Zn2+离子的原子核外排布式为1s22s22p63s23p63d10,d轨道上有10个电子,故Zn2+ 无色,Sc3+离子的原子核外排布式为1s22s22p63s23p6,其d轨道上有0电子,处于全空,故没有颜色,故答案为:3d9;3d轨道上没有未成对电子(3d轨道上电子为全空或全满).
点评 本题考查较为综合,涉及多个方面的知识,题目难度较大,本题注意晶体类型以及对数据的分析和判断,学习中注重相关基础知识和解题方法的积累.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.下列事实中,能说明CH4空间构型是正四面体的是( )
| A. | 难溶于水 | B. | CH2C12只有一种结构 | ||
| C. | 易燃气体 | D. | 不使高锰酸钾酸性溶液褪色 |
3.燃料电池是利用燃料(如H2、CO、CH4等)跟氧气或空气反应,将化学能转化成电能的装置,电解质溶液是强碱.下面关于甲烷燃料电池的说法正确的是( )
| A. | 负极反应为:O2+2H2O+4e═4OH- | |
| B. | 负极反应为:CH4+10OH--8e═CO32-+7H2O | |
| C. | 放电时溶液中的阳离子向负极移动 | |
| D. | 随放电的进行,溶液的pH值不变 |
20.运用化学反应原理研究部分单质及其化合物的反应有重要意义.
(1)氨是氮循环过程中的重要物质,是氮肥工业的重要原料.氨的合成是目前普遍使用的人工固氮方法:N2(g)+3H2(g)?2NH3(g).请回答:
①已知:H-H键能为436kJ/mol,N≡N键能为945kJ/mol,N一H键能为391kJ/mol.由键能计算消耗1molN2时的△H=-93kJ/mol.
②若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡向左移动(填“向左”、“向右”或“不”); 氨气的平衡浓度随温度变化如图所示,当合成氨平衡体系温度由T1变化到T2时,KA>KB(填“>”、“<”或“=”).
③在25°C下,将a mol•L-1的氨水与b mol•L-1的盐酸等体积混合,反应后溶液中显中性,则c(NH4+)=c(Cl-)(填“>”、“<”或“=”);
用含a和b的代数式表示出氨水的电离平衡常数表达式$\frac{10{\;}^{-7}b}{a-b}$.
(2)100℃时,若将0.100mol N2O4气体放入1L密闭容器中,发生反应N2O4?2NO2,c(N2O4)随时间的变化如表所示.回答下列问题:
①在0~40s时段,化学反应速率v(NO2)为0.0025mol•L-1•s-1;
此温度下的化学平衡常数K为0.36.
②下列能说明该反应达到平衡状态的是BD.
A.2v(N2O4)=v(NO2) B.体系的颜色不再改变
C.混合气体的密度不再改变 D.混合气体的压强不再改变
③该反应达到平衡后,降温至50℃,c(N2O4)变为0.080mol•L-1,混合气体的颜色变浅(填“深”或“浅”),该反应的正反应为吸热(填“吸热”或“放热”)反应.
④该反应达平衡后,若只改变一个条件,达新平衡时,下列能使NO2的体积分数增大的是:B
A.充入一定量的NO2 B.增大容器的容积
C.分离出一定量的NO2 D.充入一定量的N2.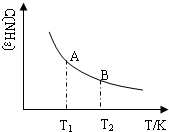
(1)氨是氮循环过程中的重要物质,是氮肥工业的重要原料.氨的合成是目前普遍使用的人工固氮方法:N2(g)+3H2(g)?2NH3(g).请回答:
①已知:H-H键能为436kJ/mol,N≡N键能为945kJ/mol,N一H键能为391kJ/mol.由键能计算消耗1molN2时的△H=-93kJ/mol.
②若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡向左移动(填“向左”、“向右”或“不”); 氨气的平衡浓度随温度变化如图所示,当合成氨平衡体系温度由T1变化到T2时,KA>KB(填“>”、“<”或“=”).
③在25°C下,将a mol•L-1的氨水与b mol•L-1的盐酸等体积混合,反应后溶液中显中性,则c(NH4+)=c(Cl-)(填“>”、“<”或“=”);
用含a和b的代数式表示出氨水的电离平衡常数表达式$\frac{10{\;}^{-7}b}{a-b}$.
(2)100℃时,若将0.100mol N2O4气体放入1L密闭容器中,发生反应N2O4?2NO2,c(N2O4)随时间的变化如表所示.回答下列问题:
| 时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4)/(mol•L-1) | 0.100 | 0.070 | 0.050 | 0.040 | 0.040 | 0.040 |
此温度下的化学平衡常数K为0.36.
②下列能说明该反应达到平衡状态的是BD.
A.2v(N2O4)=v(NO2) B.体系的颜色不再改变
C.混合气体的密度不再改变 D.混合气体的压强不再改变
③该反应达到平衡后,降温至50℃,c(N2O4)变为0.080mol•L-1,混合气体的颜色变浅(填“深”或“浅”),该反应的正反应为吸热(填“吸热”或“放热”)反应.
④该反应达平衡后,若只改变一个条件,达新平衡时,下列能使NO2的体积分数增大的是:B
A.充入一定量的NO2 B.增大容器的容积
C.分离出一定量的NO2 D.充入一定量的N2.

17.能说明醋酸是弱电解质的事实是( )
①用浓硫酸和醋酸钠固体共热可以制得醋酸,②醋酸钠水溶液呈碱性,
③可以用食醋清除水壶中的水垢,④pH=2的醋酸溶液稀释1000倍后的pH<5.
①用浓硫酸和醋酸钠固体共热可以制得醋酸,②醋酸钠水溶液呈碱性,
③可以用食醋清除水壶中的水垢,④pH=2的醋酸溶液稀释1000倍后的pH<5.
| A. | ①③④ | B. | ①② | C. | ②④ | D. | ② |
18.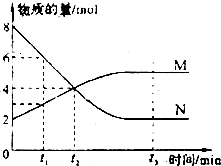 在一定温度下,容器内某反应中M、N的物质的量随反应时间变化的曲线如下图,下 列表述中正确的是( )
在一定温度下,容器内某反应中M、N的物质的量随反应时间变化的曲线如下图,下 列表述中正确的是( )
 在一定温度下,容器内某反应中M、N的物质的量随反应时间变化的曲线如下图,下 列表述中正确的是( )
在一定温度下,容器内某反应中M、N的物质的量随反应时间变化的曲线如下图,下 列表述中正确的是( )| A. | t3时,正反应速率大于逆反应速率 | |
| B. | t2时,正逆反应速率相等,反应达到平衡状态I 已反应的 | |
| C. | 化学方程式为:2M=N | |
| D. | t1时,N的浓度是M浓度的2倍 |
 .
. .
. .
.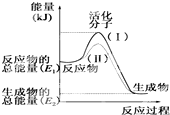 请认真观察如图,然后回答问题:
请认真观察如图,然后回答问题: