题目内容
11.在某些高档点心的包装盒内有个小纸袋,将小纸袋打开,可看到灰黑色粉末,其中有些已变成棕褐色.将灰黑色粉末溶于盐酸,取上层清液,滴入几滴氯水,再滴入KSCN溶液,马上出现血红色.以下结论不正确的是( )| A. | 该灰黑色粉末用作抗氧化剂 | B. | 小袋中的原装粉末是Fe2O3 | ||
| C. | 小袋中可能装有活性铁粉 | D. | 该灰黑色粉末不可食用 |
分析 根据题干描述,灰黑色粉末,其中有些已变成棕褐色,溶于稀盐酸,滴入几滴氯水,再滴加KSCN溶液,马上出现血红色,可知一定存在三价铁离子,原灰黑色粉末一定是铁粉,结合选项分析解答.
解答 解:由题中信息,溶于盐酸后,滴入氯水和KSCN溶液,马上出现血红色,说明溶液中存在三价铁离子,原粉末含有铁元素
A.灰黑色粉末具有氧化性,用作抗氧化剂,故A正确;
B.铁具有还原性,氧化铁不是灰黑色,且不具有还原性,不能抗氧化,所以该灰黑色粉末是铁粉,故B错误;
C.铁粉是黑色的粉末,能与空气中的氧气、水分发生缓慢氧化生成红色的铁锈,是脱氧保鲜剂,故C正确;
D.该灰黑色粉末具有还原性,用作抗氧化剂,不能食用,故D正确;
故选B.
点评 本题考查化学与生活,明确物质成分及其性质是解本题关键,侧重考查学生获取信息解答问题能力,会运用化学知识解释生活现象,题目难度不大.

练习册系列答案
相关题目
2.下列化学用语正确的是( )
| A. | 聚丙烯结构简式: | B. | 四氯化碳的电子式为: | ||
| C. | 丙烷分子的比例模型为: | D. | 2-乙基-1,3-丁二烯的键线式: |
16.下列事实中,能说明CH4空间构型是正四面体的是( )
| A. | 难溶于水 | B. | CH2C12只有一种结构 | ||
| C. | 易燃气体 | D. | 不使高锰酸钾酸性溶液褪色 |
3.燃料电池是利用燃料(如H2、CO、CH4等)跟氧气或空气反应,将化学能转化成电能的装置,电解质溶液是强碱.下面关于甲烷燃料电池的说法正确的是( )
| A. | 负极反应为:O2+2H2O+4e═4OH- | |
| B. | 负极反应为:CH4+10OH--8e═CO32-+7H2O | |
| C. | 放电时溶液中的阳离子向负极移动 | |
| D. | 随放电的进行,溶液的pH值不变 |
20.运用化学反应原理研究部分单质及其化合物的反应有重要意义.
(1)氨是氮循环过程中的重要物质,是氮肥工业的重要原料.氨的合成是目前普遍使用的人工固氮方法:N2(g)+3H2(g)?2NH3(g).请回答:
①已知:H-H键能为436kJ/mol,N≡N键能为945kJ/mol,N一H键能为391kJ/mol.由键能计算消耗1molN2时的△H=-93kJ/mol.
②若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡向左移动(填“向左”、“向右”或“不”); 氨气的平衡浓度随温度变化如图所示,当合成氨平衡体系温度由T1变化到T2时,KA>KB(填“>”、“<”或“=”).
③在25°C下,将a mol•L-1的氨水与b mol•L-1的盐酸等体积混合,反应后溶液中显中性,则c(NH4+)=c(Cl-)(填“>”、“<”或“=”);
用含a和b的代数式表示出氨水的电离平衡常数表达式$\frac{10{\;}^{-7}b}{a-b}$.
(2)100℃时,若将0.100mol N2O4气体放入1L密闭容器中,发生反应N2O4?2NO2,c(N2O4)随时间的变化如表所示.回答下列问题:
①在0~40s时段,化学反应速率v(NO2)为0.0025mol•L-1•s-1;
此温度下的化学平衡常数K为0.36.
②下列能说明该反应达到平衡状态的是BD.
A.2v(N2O4)=v(NO2) B.体系的颜色不再改变
C.混合气体的密度不再改变 D.混合气体的压强不再改变
③该反应达到平衡后,降温至50℃,c(N2O4)变为0.080mol•L-1,混合气体的颜色变浅(填“深”或“浅”),该反应的正反应为吸热(填“吸热”或“放热”)反应.
④该反应达平衡后,若只改变一个条件,达新平衡时,下列能使NO2的体积分数增大的是:B
A.充入一定量的NO2 B.增大容器的容积
C.分离出一定量的NO2 D.充入一定量的N2.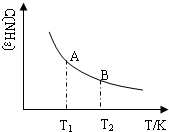
(1)氨是氮循环过程中的重要物质,是氮肥工业的重要原料.氨的合成是目前普遍使用的人工固氮方法:N2(g)+3H2(g)?2NH3(g).请回答:
①已知:H-H键能为436kJ/mol,N≡N键能为945kJ/mol,N一H键能为391kJ/mol.由键能计算消耗1molN2时的△H=-93kJ/mol.
②若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡向左移动(填“向左”、“向右”或“不”); 氨气的平衡浓度随温度变化如图所示,当合成氨平衡体系温度由T1变化到T2时,KA>KB(填“>”、“<”或“=”).
③在25°C下,将a mol•L-1的氨水与b mol•L-1的盐酸等体积混合,反应后溶液中显中性,则c(NH4+)=c(Cl-)(填“>”、“<”或“=”);
用含a和b的代数式表示出氨水的电离平衡常数表达式$\frac{10{\;}^{-7}b}{a-b}$.
(2)100℃时,若将0.100mol N2O4气体放入1L密闭容器中,发生反应N2O4?2NO2,c(N2O4)随时间的变化如表所示.回答下列问题:
| 时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4)/(mol•L-1) | 0.100 | 0.070 | 0.050 | 0.040 | 0.040 | 0.040 |
此温度下的化学平衡常数K为0.36.
②下列能说明该反应达到平衡状态的是BD.
A.2v(N2O4)=v(NO2) B.体系的颜色不再改变
C.混合气体的密度不再改变 D.混合气体的压强不再改变
③该反应达到平衡后,降温至50℃,c(N2O4)变为0.080mol•L-1,混合气体的颜色变浅(填“深”或“浅”),该反应的正反应为吸热(填“吸热”或“放热”)反应.
④该反应达平衡后,若只改变一个条件,达新平衡时,下列能使NO2的体积分数增大的是:B
A.充入一定量的NO2 B.增大容器的容积
C.分离出一定量的NO2 D.充入一定量的N2.

1.乙酸乙酯和丙酸的混合物中氧元素质量分数为30%,则氢元素的质量分数为( )
| A. | 40% | B. | 30% | C. | 10% | D. | 20% |

 .
. 、
、 .
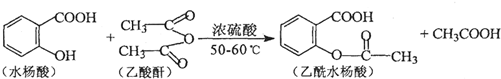
.
 .
. .
. .
.