题目内容
13.把1.2molA气体和0.8molB气体混合于容积为2L的容器中,使其发生如下反应:3A(g)+B(g)?nC(g)+2D(g),5min末生成0.4molD,若测知以C浓度变化表示的平均反应速率为0.04mol/(L•min),则n的值为( )| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
分析 D的反应速率=$\frac{\frac{0.4mol}{2L}}{5min}$=0.04mol/L,同一可逆反应中同一时间段内各物质的反应速率之比等于其计量数之比,据此判断n值.
解答 解:D的反应速率=$\frac{\frac{0.4mol}{2L}}{5min}$=0.04mol/L,同一可逆反应中同一时间段内各物质的反应速率之比等于其计量数之比,所以n:2=0.04mol/(L•min):0.04mol/(L•min)=1:1,所以n=2,故选A.
点评 本题考查化学反应速率有关计算,侧重考查学生分析计算能力,明确计量数之比与反应速率之比关系是解本题关键,题目难度不大.

练习册系列答案
相关题目
3.如图装置的电池总反应为2Ag+Cl2═2AgCl.下列说法正确的是( )
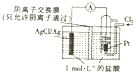

| A. | 正极反应式为Ag-e-=Ag+ | |
| B. | 放电时,溶液中的Cl-向负极移动 | |
| C. | 通入Cl2的一极为负极 | |
| D. | 当电路中转移0.01mole-时,消耗Ag的质量为2.16g |
4.设NA是阿伏加德罗常数的数值,下列说法不正确的是( )
| A. | 标准状况下,2.24 L Cl2溶于水,转移的电子数目为0.1NA | |
| B. | 1 mol Na2O和Na2O2混合物中含有的阴、阳离总数是3 NA | |
| C. | 常温常压下,8 g SO3所含的氧原子的数目为0.3NA | |
| D. | 过氧化钠与H2O反应,每生成0.1mol氧气,转移电子的数目为0.2NA |
1.下列物质属于同位素的一组是( )
| A. | 1H和3H | B. | 淀粉和纤维素 | ||
| C. | O2与O3 | D. | CH4与CH3-CH2-CH3 |
8.甲烷作为一种新能源在化学领域应用广泛,用作燃料电池的电极反应为:负极:CH4+10OH--8e-═CO32-+7H2O,正极:2O2+4H2O+8e-═8OH-,该电池工作时,下列叙述正确的是( )
| A. | 氧气发生氧化反应 | |
| B. | 每转移2mol电子,电池内增加2molH2O | |
| C. | C正极附近c(H+)增大 | |
| D. | 负极附近溶液的pH值降低 |
18.化学与生活联系紧密,下列说法正确的是( )
| A. | 食品包装袋中常用生石灰做食品的防腐剂 | |
| B. | 硫酸钙溶液不能使豆浆中的蛋白质发生聚沉而制取豆腐 | |
| C. | 金属钠着火可用碳酸氢钠干粉灭火器灭火 | |
| D. | “84消毒液”具有强氧化性,可以杀死流感病毒 |
5.下列离子方程式正确的是( )
| A. | 用氯化铁溶液腐蚀印刷电路板:Fe3++Cu═Fe2++Cu2+ | |
| B. | 过氧化钠与水反应制备氧气:Na2O2+2H2O═2N++2OH-+O2↑ | |
| C. | 硫酸亚铁溶液中通氯气:2Fe2++Cl2═2Fe3++2Cl- | |
| D. | 用惰性电极电解饱和食盐水:2H++2Cl-═H2↑+Cl2↑ |
2.下列离子方程式书写正确的是( )
| A. | 将磁性氧化铁溶于盐酸:Fe3O4+8H+═3Fe3++4H2O | |
| B. | 向AlCl3溶液中滴加氨水:Al3++3OH-═Al(OH)3↓ | |
| C. | Fe2O3与氢碘酸反应:Fe2O3+6H+═2Fe3++3H2O | |
| D. | 向氯化亚铁溶液中滴加稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O |
3.下列反应(均已配平)中,氧化剂与还原剂物质的量的关系不是1:1的是( )
| A. | 3Cl2+6NaOH$\frac{\underline{\;△\;}}{\;}$5NaCl+NaClO3+3H2O | |
| B. | Fe+CuSO4=FeSO4+Cu | |
| C. | Cu+2H2SO4(浓)$\frac{\underline{\;△\;}}{\;}$CuSO4+SO2↑+2H2O | |
| D. | 2Na+2HCl═2NaCl+H2↑ |