题目内容
9.磺酰氯(SO2Cl2)是一种有机氯化剂,也是锂电池正极活性物质.已知磺酰氯是一种无色液体,熔点-54.1℃,沸点69.1℃,遇水发生剧烈水解.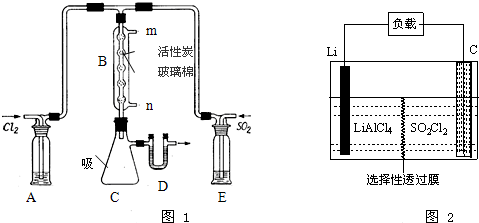
(1)已知:SO2 (g)+Cl2 (g)+SCl2 (g)?2SOCl2 (g)△H=a kJ•mol-1
SO2Cl2(g)+SCl2 (g)?2SOCl2(g)△H=b kJ•mol-1
则反应:SO2(g)+Cl2 (g)?SO2Cl2(g)△H=a-bkJ•mol-1(用含a、b的代数式表示);该反应平衡常数表达式为K=$\frac{c(SO{\;}_{2}C{l}_{2})}{c(S{O}_{2})•c(C{l}_{2})}$.
(2)磺酰氯可与白磷发生反应为:P4+10 SO2Cl2═4PCl5+10SO2↑,若生成1molSO2,则转移电子的物质的量为2mol.
(3)某学习小组的同学依据反应:SO2(g)+Cl2(g)?SO2Cl2(g)△H<0,设计的制备磺酰氯装置如题图1.
①若用浓盐酸与二氧化锰为原料制取Cl2,其反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
②有关题图1所示的装置说法正确的是bde(不定项选择).
a.A、E处洗气瓶中盛放的可能分别是饱和食盐水和饱和Na2SO3溶液
b.B处反应管内五球中玻璃棉上的活性炭作催化剂
c.B处反应管冷却水应从m接口通入
d.装置C处吸滤瓶应放在冰水中冷却
e.D处U形管中盛放的可能是碱石灰
③从化学平衡移动角度分析,反应管通水冷却的目的为冷凝、降温均有利于SO2Cl2生成.
(4)GET公司开发的Li-SO2Cl2军用电池,其示意图如题图2所示,已知电池反应为:2Li+SO2Cl2═2LiCl+SO2↑;则电池工作时,正极的电极反应式为SO2Cl2+2e-=2Cl-+SO2↑.
分析 (1)根据盖斯定律计算分析得到,和平衡常数表达式定义书写;
(2)由方程式可知P4+10 SO2Cl2=4PCl5+10SO2↑,P4~~10SO2~~20mole-,由此分析解答;
(3)①若用浓盐酸与二氧化锰为原料制取Cl2的方程式为:MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O;
②a.A、E处洗气瓶,干燥吸水,二氧化硫和氯气都可以用浓硫酸干燥,而饱和食盐水和饱和NaHSO3溶液起不到干燥的作用,故错误;
b.B处反应管内五球中玻璃棉上的活性炭对氯气和二氧化硫的反应起催化作用,故正确;
c.B处反应管冷却水应低处进高处出,所以从n接口通入,故错误;
d.装置C处吸滤瓶应放在冰水中冷却,利平衡正向移动,提高产率,故正确;
e.D处U形管中盛放的固体干燥剂,可能是固体碱石灰,故正确;
③SO2(g)+Cl2(g)?SO2Cl2(g)△H<0,正反应是放热反应,所以水冷却利于SO2Cl2的合成;
(4)正极是SO2Cl2中+6价的硫得电子发生还原反应.
解答 解:(1)SO2 (g)+Cl2 (g)+SCl2 (g)?2SOCl2 (g)△H=a kJ•mol-1…Ⅰ
SO2Cl2(g)+SCl2 (g)?2SOCl2(g)△H=b kJ•mol-1…Ⅱ
根据盖斯定律Ⅰ-Ⅱ得:SO2(g)+Cl2(g)?SO2Cl2(g)△H=(a-b )kJ•mol-1,平衡常数K=$\frac{c(SO{\;}_{2}C{l}_{2})}{c(S{O}_{2})•c(C{l}_{2})}$,
故答案为:a-b;$\frac{c(SO{\;}_{2}C{l}_{2})}{c(S{O}_{2})•c(C{l}_{2})}$;
(2)由方程式可知P4+10 SO2Cl2=4PCl5+10SO2↑,P4~~10SO2~~20mole-,所以生成1molSO2,则转移电子的物质的量为2mol,
故答案为:2;
(3)①若用浓盐酸与二氧化锰为原料制取Cl2的方程式为:MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O;
②a.A、E处洗气瓶,干燥吸水,二氧化硫和氯气都可以用浓硫酸干燥,而饱和食盐水和饱和NaHSO3溶液起不到干燥的作用,故错误;
b.B处反应管内五球中玻璃棉上的活性炭对氯气和二氧化硫的反应起催化作用,故正确;
c.B处反应管冷却水应低处进高处出,所以从n接口通入,故错误;
d.装置C处吸滤瓶应放在冰水中冷却,利平衡正向移动,提高产率,故正确;
e.D处U形管中盛放的固体干燥剂,可能是固体碱石灰,故正确;
故选:bde;
③SO2(g)+Cl2(g)?SO2Cl2(g)△H<0,正反应是放热反应,所以水冷却利于SO2Cl2的合成,
故答案为:冷凝、降温均有利于SO2Cl2生成;
(4)正极是SO2Cl2中+6价的硫得电子发生还原反应,所以电极反应式为:SO2Cl2+2e-=2Cl-+SO2↑,
故答案为:SO2Cl2+2e-=2Cl-+SO2↑.
点评 本题考查了盖斯定律和氧化还原的相关计算、化学方程式的书写、化学平衡常数的表达式、平衡移动和电极反应式的书写,难度不大,盖斯定律注意利用方程式相加减的方法处理.

 互动英语系列答案
互动英语系列答案| 序号 | 操作及现象 | 结论 |
| A | 将pH为11的氨水稀释10倍,测量所得pH大于10 | 加水稀释NH3•H2O的电离程度减小 |
| B | 常温下,测得饱和Na2CO3溶液的pH大于饱和NaHCO3溶液 | 水解程度:CO32->HCO3- |
| C | 镁粉加入NH4Cl溶液中,有刺激性气味气体放出 | 该气体含有NH3 |
| D | 某气体能使酸性KMnO4溶液褪色 | 该气体一定是SO2 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 单位时间内生成n mol X,同时消耗3n molY | |
| B. | X的生成速率与Z的生成速率相等 | |
| C. | X、Y、Z的物质的量分数均保持不变 | |
| D. | X、Y、Z的分子个数比为3:1:2 |
| A. | 标准状况下,2.24 L Cl2溶于水,转移的电子数目为0.1NA | |
| B. | 1 mol Na2O和Na2O2混合物中含有的阴、阳离总数是3 NA | |
| C. | 常温常压下,8 g SO3所含的氧原子的数目为0.3NA | |
| D. | 过氧化钠与H2O反应,每生成0.1mol氧气,转移电子的数目为0.2NA |
| A. | 80g CuO和Cu2S的混合物含有铜原子数一定为NA | |
| B. | 电解精炼铜时,当电路中转移NA个电子,阳极溶解32g铜 | |
| C. | 1mol铁与1molCl2充分反应,转移电子数为3NA | |
| D. | 向含有FeI2的溶液中通入适量氯气,当有1mol Fe2+被氧化时该反应转移电子的数目至少为NA |
| A. | 1H和3H | B. | 淀粉和纤维素 | ||
| C. | O2与O3 | D. | CH4与CH3-CH2-CH3 |
| A. | 食品包装袋中常用生石灰做食品的防腐剂 | |
| B. | 硫酸钙溶液不能使豆浆中的蛋白质发生聚沉而制取豆腐 | |
| C. | 金属钠着火可用碳酸氢钠干粉灭火器灭火 | |
| D. | “84消毒液”具有强氧化性,可以杀死流感病毒 |
下列说法正确的是( )
| A. | 该混合物中铜的质量为19.2 g | |
| B. | 与该混合物反应消耗的HNO3的量为1.2 mol | |
| C. | 加入NaOH溶液的体积是800 mL | |
| D. | Cu2+沉淀完全后,溶液中c(NO3-)为0.7 mol/L |