题目内容
8.已知相同状况下,气体间的分子个数比等于其体积比,现有CO、O2、CO2的混合气体9mL,点火爆炸后恢复到原来状态时,体积减小1mL,通过氢氧化钠溶液后,体积又减少3.5mL,则原混合气体中CO、O2、CO2的体积比是多少?分析 点燃爆炸发生反应为:2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2,利用差量法计算参加反应CO、氧气体积、生成的二氧化碳体积,再通过足量的浓NaOH溶液时,二氧化碳被吸收(包含生成的二氧化碳、原混合气体中的二氧化碳),进而计算原混合气体中二氧化碳体积,剩余气体为CO或O2,据此讨论并结合方程式计算.
解答 解:点燃爆炸后气体体积减少1mL,则:
2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2气体体积减少
2 1 2 2+1-2=1
2mL 1mL 2mL 1mL
爆炸后的气体体积为:9mL-1mL=8mL,通过足量的浓NaOH溶液时,体积又减少3.5mL,则原混合气体中CO2为:3.5mL-2mL=1.5mL,
若剩余气体为CO,则原混合气体中O2为1mL,CO为:9mL-1mL-1mL=7mL,则原混合气体中CO、O2、CO2的体积比为:7mL:1mL:1.5mL=14:2:3;
若剩余气体为O2,则原混合气体中CO为2mL,O2为:9mL-2mL-1.5mL=5.5mL,则原混合气体中CO、O2、CO2的体积比为2mL:5.5mL:1.5mL=4:11:3;
答:原混合气体中CO、O2、CO2的体积比为14:2:3(CO过量)或4:11:3(氧气过量).
点评 本题考查混合物反应的计算,题目难度中等,注意利用差量法计算参加反应CO、氧气体积、生成的二氧化碳体积,关键是讨论剩余气体成分,再结合方程式计算.

练习册系列答案
相关题目
18.化学与生活联系紧密,下列说法正确的是( )
| A. | 食品包装袋中常用生石灰做食品的防腐剂 | |
| B. | 硫酸钙溶液不能使豆浆中的蛋白质发生聚沉而制取豆腐 | |
| C. | 金属钠着火可用碳酸氢钠干粉灭火器灭火 | |
| D. | “84消毒液”具有强氧化性,可以杀死流感病毒 |
19.现有一定量的Cu和CuO混合物,向其中加入0.6L 2.0mol/L稀硝酸,混合物完全溶解,同时生成4.48L NO(标准状况).向所得溶液中加入一定体积1.0mol/L NaOH溶液,恰好使Cu2+沉淀完全,沉淀经洗涤、充分灼烧后得32.0g固体.(忽略溶液的体积变化).
下列说法正确的是( )
下列说法正确的是( )
| A. | 该混合物中铜的质量为19.2 g | |
| B. | 与该混合物反应消耗的HNO3的量为1.2 mol | |
| C. | 加入NaOH溶液的体积是800 mL | |
| D. | Cu2+沉淀完全后,溶液中c(NO3-)为0.7 mol/L |
16.下列各组离子,在强碱性溶液中可以大量共存的是( )
| A. | Na+、Ba2+、Cl-、SO42- | B. | Na+、Ba2+、AlO2-、NO3- | ||
| C. | NH4+、K+、Cl-、NO3- | D. | Na+、K+、NO3-、SiO32- |
3.下列反应(均已配平)中,氧化剂与还原剂物质的量的关系不是1:1的是( )
| A. | 3Cl2+6NaOH$\frac{\underline{\;△\;}}{\;}$5NaCl+NaClO3+3H2O | |
| B. | Fe+CuSO4=FeSO4+Cu | |
| C. | Cu+2H2SO4(浓)$\frac{\underline{\;△\;}}{\;}$CuSO4+SO2↑+2H2O | |
| D. | 2Na+2HCl═2NaCl+H2↑ |
13.类比推理的方法是化学学习与研究中有广泛的应用,但有时会得出错误的结论,以下几种类比推理结论中正确的是( )
| A. | H2SO4为强酸,推出HClO4为强酸 | |
| B. | Fe3Cl8可以改写为FeCl2 •2FeCl3,推出Fe3I8可以改写为FeI2 •2FeI3 | |
| C. | NH3的沸点高于PH3,推出CH4沸点高于SiH4 | |
| D. | CO2 通入Ba(NO3)2 溶液中无沉淀生成,推出SO2通入Ba(NO3)2 溶液中无沉淀生成 |
20.一定条件下,在容积为1L密闭容器发生可逆反应:A(g)+2B(g)?2C(g),实验测得当生成2mol C时,放出了QkJ的热量.若条件不变起始向容器中充入1mol C,则反应达平衡时的热效应为( )
| A. | 放出0.5QkJ的热量 | B. | 吸收0.5QkJ的热量 | ||
| C. | 放出的热量小于0.5QkJ | D. | 吸收的热量小于0.5QkJ |
7.下列实验过程中,溶液的pH减小的是( )
| A. | 以碳棒为两极电解氢氧化钠溶液 | B. | 向稀盐酸中滴加NaOH溶液 | ||
| C. | 以碳棒为两极电解饱和氯化钠溶液 | D. | 向氢氧化钠溶液中加水 |
8.烧杯中盛有100mL 0.1mol/L的NaHSO4溶液,向其中逐滴滴加0.1mol/L的Ba(OH)2溶液,烧杯中某些物质(或微粒)的物质的量的变化曲线如图.下列说法正确的是( )
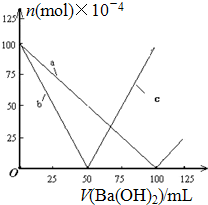

| A. | 曲线a表示Ba2+的物质的量的变化 | |
| B. | 曲线c表示OH-的物质的量的变化 | |
| C. | 加入Ba(OH)2溶液50mL时反应的离子方程式为:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 加入Ba(OH)2溶液大于50mL后,反应的离子方程式为:OH-+H+═H2O |