题目内容
10.已知下列甲、乙两种有机物的结构简式,回答下列问题: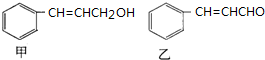
(1)甲、乙中含氧官能团的名称为醇羟基;醛基.
(2)由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):
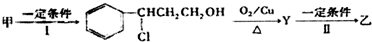
其中反应I的化学方程式为
 +HCl$\stackrel{一定条件下}{→}$
+HCl$\stackrel{一定条件下}{→}$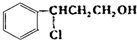 ,反应II的反应类型为消去反应.
,反应II的反应类型为消去反应.(3)甲能形成高聚物,该高聚物的结构简式为
 .
.
分析 (1)甲、乙中含氧官能团的名称分别为醇羟基、醛基;
(2)甲和HCl发生加成反应生成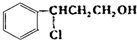 ,
,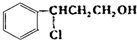 发生催化氧化反应生成Y,Y结构简式为
发生催化氧化反应生成Y,Y结构简式为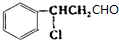 ,Y发生消去反应生成乙;
,Y发生消去反应生成乙;
(3)甲发生加聚反应生成高分子化合物.
解答 解:(1)甲、乙中含氧官能团的名称分别为醇羟基、醛基,故答案为:醇羟基;醛基;
(2)甲和HCl发生加成反应生成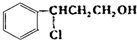 ,
,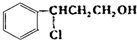 发生催化氧化反应生成Y,Y结构简式为
发生催化氧化反应生成Y,Y结构简式为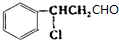 ,Y发生消去反应生成乙;
,Y发生消去反应生成乙;
I的反应方程式为 +HCl$\stackrel{一定条件下}{→}$
+HCl$\stackrel{一定条件下}{→}$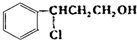 ;II的反应类型是消去反应,故答案为:
;II的反应类型是消去反应,故答案为: +HCl$\stackrel{一定条件下}{→}$
+HCl$\stackrel{一定条件下}{→}$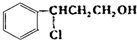 ;消去反应;
;消去反应;
(3)甲发生加聚反应生成高分子化合物,结构简式为 ,
,
故答案为: .
.
点评 本题考查有机物官能团及其结构,涉及有机物推断及方程式的书写,正确判断结构简式是解本题关键,知道常见官能团及其性质,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.根据如表实验操作及现象,能得到相应结论的是( )
| 序号 | 操作及现象 | 结论 |
| A | 将pH为11的氨水稀释10倍,测量所得pH大于10 | 加水稀释NH3•H2O的电离程度减小 |
| B | 常温下,测得饱和Na2CO3溶液的pH大于饱和NaHCO3溶液 | 水解程度:CO32->HCO3- |
| C | 镁粉加入NH4Cl溶液中,有刺激性气味气体放出 | 该气体含有NH3 |
| D | 某气体能使酸性KMnO4溶液褪色 | 该气体一定是SO2 |
| A. | A | B. | B | C. | C | D. | D |
1.下列物质属于同位素的一组是( )
| A. | 1H和3H | B. | 淀粉和纤维素 | ||
| C. | O2与O3 | D. | CH4与CH3-CH2-CH3 |
18.化学与生活联系紧密,下列说法正确的是( )
| A. | 食品包装袋中常用生石灰做食品的防腐剂 | |
| B. | 硫酸钙溶液不能使豆浆中的蛋白质发生聚沉而制取豆腐 | |
| C. | 金属钠着火可用碳酸氢钠干粉灭火器灭火 | |
| D. | “84消毒液”具有强氧化性,可以杀死流感病毒 |
5.下列离子方程式正确的是( )
| A. | 用氯化铁溶液腐蚀印刷电路板:Fe3++Cu═Fe2++Cu2+ | |
| B. | 过氧化钠与水反应制备氧气:Na2O2+2H2O═2N++2OH-+O2↑ | |
| C. | 硫酸亚铁溶液中通氯气:2Fe2++Cl2═2Fe3++2Cl- | |
| D. | 用惰性电极电解饱和食盐水:2H++2Cl-═H2↑+Cl2↑ |
15.下列说法正确的是( )
| A. | 原子最外层电子数为2的元素一定处于周期表ⅡA族 | |
| B. | 主族元素X、Y能形成XY2型化合物,则X与Y的原子序数之差可能为2或5 | |
| C. | 氯化氢的沸点比溴化氢的沸点高 | |
| D. | Li、Na、K单质的熔点逐渐升高 |
2.下列离子方程式书写正确的是( )
| A. | 将磁性氧化铁溶于盐酸:Fe3O4+8H+═3Fe3++4H2O | |
| B. | 向AlCl3溶液中滴加氨水:Al3++3OH-═Al(OH)3↓ | |
| C. | Fe2O3与氢碘酸反应:Fe2O3+6H+═2Fe3++3H2O | |
| D. | 向氯化亚铁溶液中滴加稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O |
19.现有一定量的Cu和CuO混合物,向其中加入0.6L 2.0mol/L稀硝酸,混合物完全溶解,同时生成4.48L NO(标准状况).向所得溶液中加入一定体积1.0mol/L NaOH溶液,恰好使Cu2+沉淀完全,沉淀经洗涤、充分灼烧后得32.0g固体.(忽略溶液的体积变化).
下列说法正确的是( )
下列说法正确的是( )
| A. | 该混合物中铜的质量为19.2 g | |
| B. | 与该混合物反应消耗的HNO3的量为1.2 mol | |
| C. | 加入NaOH溶液的体积是800 mL | |
| D. | Cu2+沉淀完全后,溶液中c(NO3-)为0.7 mol/L |
20.一定条件下,在容积为1L密闭容器发生可逆反应:A(g)+2B(g)?2C(g),实验测得当生成2mol C时,放出了QkJ的热量.若条件不变起始向容器中充入1mol C,则反应达平衡时的热效应为( )
| A. | 放出0.5QkJ的热量 | B. | 吸收0.5QkJ的热量 | ||
| C. | 放出的热量小于0.5QkJ | D. | 吸收的热量小于0.5QkJ |