题目内容
13.下列物质性质与应用对应关系正确的是( )| A. | 液氨汽化时吸收大量的热,可用作制冷剂 | |
| B. | 硅酸钠溶液呈碱性,可用作木材防火剂 | |
| C. | NaHCO3能与碱反应,可用作焙制糕点的膨松剂 | |
| D. | Fe比Cu活泼,可用FeCl3溶液腐蚀线路板上的Cu |
分析 A.物质的汽化过程是吸热的;
B.硅酸钠可用于阻燃剂;
C.碳酸氢钠和酸反应生成二氧化碳;
D.FeCl3溶液可以腐蚀线路板上的Cu,说明三价铁氧化性比铜离子强.
解答 解:A.液氨汽化时要吸收大量的热,能使周围温度降低,液氨常用作制冷剂,故A正确;
B.硅酸钠可用于阻燃剂,用硅酸钠浸泡的木材可防火,故B错误;
C.NaHCO3用作糕点的膨松剂,是利用碳酸氢钠和酸反应生成二氧化碳,故C错误;
D.FeCl3溶液可以腐蚀线路板上的Cu,说明三价铁氧化性比铜离子强,与Fe比Cu活泼无关,故D错误.
故选A.
点评 本题综合考查元素化合物知识,为高考常见题型和高频考点,侧重于基础知识的理解和运用的考查,有利于培养学生的良好的科学素养,提高学习的积极性,难度不大.

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目
17.用NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 0.1 mol 的2H35Cl分子中的中子数是2NA | |
| B. | 1 mol乙醇所含的羟基的电子数是9NA | |
| C. | 在含Al3+总数为NA的AlCl3溶液中,Cl-总数为3NA | |
| D. | 将2.24 L(标准状况下)CO2通入1 L 0.15 mol•L-1的NaOH溶液中,所得CO32-和HCO3-物质的量均为0.05mol |
4.乙烯催化氧化成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2=CH2+O2→2CH3CHO.下列有关说法正确的是( )
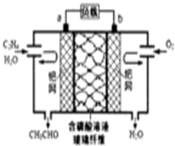

| A. | 每有0.1molO2反应,则迁移H+0.4mol | |
| B. | 该电池为可充电电池 | |
| C. | 电子移动方向:电极a→磷酸溶液→电极b | |
| D. | 正极反应式为:CH2=CH2-2e-+2OH→CH3CHO+H2O |
1.下列实验操作、现象和解释都正确的是( )
| 选项 | 实验操作 | 现象 | 解释 |
| A | 向某溶液中加入盐酸 | 产生无色气体 | 溶液中一定含有CO32- |
| B | 新制Fe(OH)2露置于空气中一段时间 | 白色固体迅速变为灰绿色,最终变为红褐色 | 说明Fe(OH)2易被氧化成Fe(OH)3 |
| C | 在CuSO4溶液中加入KI溶液,再加入苯,振荡 | 上层呈紫红色,下层有白色沉淀生产 | 铜离子可以氧化碘离子,白色沉淀可能为CuI |
| D | 向某无色溶液中滴加硝酸酸化的BaCl2溶液 | 产生白色沉淀 | 溶液中一定含有SO42- |
| A. | A | B. | B | C. | C | D. | D |
8.海洋是地球上最广阔的水体的总称,其含水量约占地球上总水量的97%.
(1)海水中含有许多化学物质,不能直接饮用,所以将海水转化为淡水是一项重大科研课题.电渗析法是近年来发展起来的一种较好的海水淡化技术,其原理如图所示,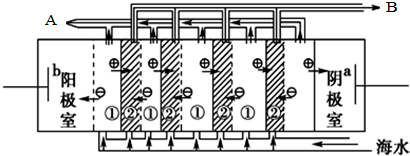 电渗析法淡化海水时阴极室可获得的重要化工原料有氢气、氢氧化钠.
电渗析法淡化海水时阴极室可获得的重要化工原料有氢气、氢氧化钠.
(2)海水中含有大量的NaCl,盐田法仍是目前海水制盐的主要方法.盐田分为贮水池、蒸发池和结晶池,建盐田必须在BC处建立(填写序号).
A.选在离江河入海口比较近的地方B.多风少雨C.潮汐落差大且又平坦空旷的海滩
(3)盐田中所得为粗盐,若想用粗盐制烧碱,需对所用食盐水进行两次精制.第一次精制主要是用沉淀法除去粗盐水中的Ca2+、Mg2+、Fe3+、SO42-等离子,流程如下:
粗盐水$\stackrel{过量BaCl_{2}溶液}{→}$$\stackrel{过量Na_{2}CO_{3}溶液}{→}$$\stackrel{过量NaOH溶液}{→}$$\stackrel{过滤}{→}$滤液$→_{调pH}^{盐酸}$第一次精制食盐水
已知:20°C部分沉淀的溶解度(g)如下表:
①检测Fe3+是否除尽的方法是取过程 III的滤液于试管中,向其中滴加KSCN溶液,若溶液不变色证明Fe3+已经沉淀干净,反之没除净.
②运用表中数据解释过程I选用BaCl2而不选用CaCl2的原因BaSO4的溶解度比CaSO4的更小,可将SO42-沉淀的更完全.
(4)工业上通常以NaCl、CO2 和 NH3 为原料制取纯碱,请写出第一步制取NaHCO3的化学方程式NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl.
(5)工业制得的纯碱常含有NaCl杂质,用下述方法可以测定样品中NaCl的质量分数.样品m克$→_{溶解}^{H_{2}O}$溶液$→_{过滤}^{过量BaCl_{2}溶液}$沉淀$→_{洗涤}^{H_{2}O}$$\stackrel{低温烘干、冷却、称量}{→}$固体n克
①检验沉淀是否洗涤干净的方法是取最后一次洗涤液于试管中,加入稀H2SO4溶液(或AgNO3(HNO3)溶液),若产生白色沉淀,则沉淀没有洗涤干净;若无白色沉淀,则沉淀已洗涤干净;
②样品中NaCl质量分数的数学表达式为(1-$\frac{106n}{197m}$)×100%.
(1)海水中含有许多化学物质,不能直接饮用,所以将海水转化为淡水是一项重大科研课题.电渗析法是近年来发展起来的一种较好的海水淡化技术,其原理如图所示,
 电渗析法淡化海水时阴极室可获得的重要化工原料有氢气、氢氧化钠.
电渗析法淡化海水时阴极室可获得的重要化工原料有氢气、氢氧化钠.(2)海水中含有大量的NaCl,盐田法仍是目前海水制盐的主要方法.盐田分为贮水池、蒸发池和结晶池,建盐田必须在BC处建立(填写序号).
A.选在离江河入海口比较近的地方B.多风少雨C.潮汐落差大且又平坦空旷的海滩
(3)盐田中所得为粗盐,若想用粗盐制烧碱,需对所用食盐水进行两次精制.第一次精制主要是用沉淀法除去粗盐水中的Ca2+、Mg2+、Fe3+、SO42-等离子,流程如下:
粗盐水$\stackrel{过量BaCl_{2}溶液}{→}$$\stackrel{过量Na_{2}CO_{3}溶液}{→}$$\stackrel{过量NaOH溶液}{→}$$\stackrel{过滤}{→}$滤液$→_{调pH}^{盐酸}$第一次精制食盐水
已知:20°C部分沉淀的溶解度(g)如下表:
| CaSO4 | CaCO3 | BaSO4 | BaCO3 |
| 2.6×10-2 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |
②运用表中数据解释过程I选用BaCl2而不选用CaCl2的原因BaSO4的溶解度比CaSO4的更小,可将SO42-沉淀的更完全.
(4)工业上通常以NaCl、CO2 和 NH3 为原料制取纯碱,请写出第一步制取NaHCO3的化学方程式NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl.
(5)工业制得的纯碱常含有NaCl杂质,用下述方法可以测定样品中NaCl的质量分数.样品m克$→_{溶解}^{H_{2}O}$溶液$→_{过滤}^{过量BaCl_{2}溶液}$沉淀$→_{洗涤}^{H_{2}O}$$\stackrel{低温烘干、冷却、称量}{→}$固体n克
①检验沉淀是否洗涤干净的方法是取最后一次洗涤液于试管中,加入稀H2SO4溶液(或AgNO3(HNO3)溶液),若产生白色沉淀,则沉淀没有洗涤干净;若无白色沉淀,则沉淀已洗涤干净;
②样品中NaCl质量分数的数学表达式为(1-$\frac{106n}{197m}$)×100%.
18.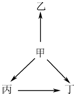 下列各组物质中,物质之间通过一步反应就能实现如图所示变化的是( )
下列各组物质中,物质之间通过一步反应就能实现如图所示变化的是( )
 下列各组物质中,物质之间通过一步反应就能实现如图所示变化的是( )
下列各组物质中,物质之间通过一步反应就能实现如图所示变化的是( )| 选项 | 甲 | 乙 | 丙 | 丁 |
| A | N2 | NH3 | NO | NO2 |
| B | Na | Na2O | NaOH | Na2O2 |
| C | SiO2 | SiF4 | H2SiO3 | Na2SiO3 |
| D | Al | AlCl3 | Al2O3 | NaAlO2 |
| A. | A | B. | B | C. | C | D. | D |
2.W、X、Y、Z是四种短周期元素,其原子序数依次增大.已知甲是由其中三种元素组成的化合物,25℃时0.1mo1.L-1甲溶液的pH为13.X元素的气态氢化物可与其最高价氧化物对应的水化物反应生成盐.下列说法中,正确的是( )
| A. | 原子半径大小的比较:r(X)>r(Y)>r(Z) | |
| B. | 元素Y、Z的简单离子的电子层结构不同 | |
| C. | 元素X的简单气态氢化物的热稳定性比元素Y的强 | |
| D. | 只含W、X、Y三种元素的化合物中,有离子化合物,也有共价化合物 |
3.下列离子方程式正确的是( )
| A. | 向Ba(OH)2溶液中滴入硫酸溶液:Ba2++SO42-═BaSO4↓ | |
| B. | 向Na2CO3溶液中通入过量CO2气体:CO32-+CO2+H2O═2HCO3- | |
| C. | BaCO3溶于醋酸溶液:BaCO3+2H+═Ba2++H2O+CO2↑ | |
| D. | 金属铝溶于氢氧化钠溶液:Al+2OH-═AlO2-+H2↑ |