题目内容
17.用NA表示阿伏加德罗常数,下列说法正确的是( )| A. | 0.1 mol 的2H35Cl分子中的中子数是2NA | |
| B. | 1 mol乙醇所含的羟基的电子数是9NA | |
| C. | 在含Al3+总数为NA的AlCl3溶液中,Cl-总数为3NA | |
| D. | 将2.24 L(标准状况下)CO2通入1 L 0.15 mol•L-1的NaOH溶液中,所得CO32-和HCO3-物质的量均为0.05mol |
分析 A、1mol2H35Cl中含19mol中子;
B、根据羟基呈电中性来分析;
C、Al3+是弱碱阳离子,在溶液中会水解;
D、根据原子守恒来分析.
解答 解:A、1mol2H35Cl中含19mol中子,故A错误;
B、1mol乙醇中含1mol-OH,而羟基呈电中性,故1mol-OH含9mol电子,故B正确;
C、Al3+是弱碱阳离子,在溶液中会水解,故当Al3+总数为NA,Cl-总数大于3NA,故C错误;
D、2.24L(标准状况下)CO2的物质的量为0.1mol,根据碳原子守恒可知,CO32-、HCO3-和H2CO3的物质的量为0.1NA,故CO32-和HCO3-物质的量小于0.1NA,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握公式的使用和物质的结构、状态是解题关键,难度不大.

练习册系列答案
相关题目
7.在铜制品上的铝质铆钉,在潮湿空气中容易腐蚀的原因是( )
| A. | 形成原电池时,铝作阴极极 | |
| B. | 形成原电池时,铜作负极 | |
| C. | 形成原电池时,电流由铝经导线流向铜 | |
| D. | 铝铆钉发生了电化学腐蚀 |
8.实验室用锌粒与2mol•L-1硫酸溶液制取氢气,下列措施能增大化学反应速率的是( )
| A. | 加入CH3COONa溶液 | B. | 改用3 mol•L-1盐酸 | ||
| C. | 用锌粉代替锌粒 | D. | 加入少量铜粉 |
12.下列表示对应化学反应的离子方程式正确的是( )
| A. | 醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-═CO32-+H2O | |
| C. | 将氯气溶于水制备次氯酸:Cl2+H2O═2H++Cl-+ClO- | |
| D. | Fe3O4溶于足量浓盐酸:Fe3O4+8H+═Fe2++2Fe3++4H2O |
2.下列物质中一定互为同系物的是( )
①CH4 ②C3H6 ③C8H18 ④CH2=CHCH2CH3 ⑤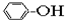 ⑥
⑥ ⑦
⑦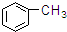 ⑧
⑧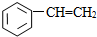
①CH4 ②C3H6 ③C8H18 ④CH2=CHCH2CH3 ⑤
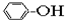 ⑥
⑥ ⑦
⑦ ⑧
⑧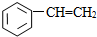
| A. | ①③ | B. | ②④ | C. | ⑤⑥ | D. | ⑦⑧ |
9.下列措施中,能加快化学反应速率的是( )
| A. | 食物储存在冰箱里 | |
| B. | 向H2O2溶液中加入MnO2 | |
| C. | 用块状碳酸钙代替粉末状碳酸钙与稀盐酸反应 | |
| D. | 用0.1 mol/L H2SO4溶液代替1 mol/L H2SO4溶液与锌粒反应 |
12.某种快速充电电池的电极材料分别为锂和石墨,电解液是LiAlCl4-SOCl2.电池的总反应可表示为:4LiCl+S+SO2$?_{放电}^{充电}$4Li+2SOCl2.下列说法正确的是( )
| A. | 该电池放电时,负极材料为锂,发生还原反应 | |
| B. | 组装该电池可以在有氧的条件下进行 | |
| C. | 电池放电时电子从负极经外电路流向正极,再从正极经电解液流向负极 | |
| D. | 电池充电时阳极反应式为:4Cl-+S+SO2-4e-=2SOCl2 |
13.下列物质性质与应用对应关系正确的是( )
| A. | 液氨汽化时吸收大量的热,可用作制冷剂 | |
| B. | 硅酸钠溶液呈碱性,可用作木材防火剂 | |
| C. | NaHCO3能与碱反应,可用作焙制糕点的膨松剂 | |
| D. | Fe比Cu活泼,可用FeCl3溶液腐蚀线路板上的Cu |

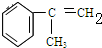 C的结构简式:
C的结构简式: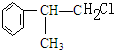 .
. +NaCl.
+NaCl.