题目内容
4.乙烯催化氧化成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2=CH2+O2→2CH3CHO.下列有关说法正确的是( )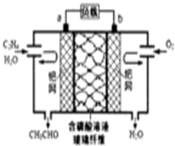
| A. | 每有0.1molO2反应,则迁移H+0.4mol | |
| B. | 该电池为可充电电池 | |
| C. | 电子移动方向:电极a→磷酸溶液→电极b | |
| D. | 正极反应式为:CH2=CH2-2e-+2OH→CH3CHO+H2O |
分析 由总反应式可知CH2=CH2被氧化,应为原电池的负极反应,因电解质溶液呈酸性,则负极电极方程式为CH2=CH2-2e-+H2O=CH3CHO+2H+,正极通入氧气,发生还原反应,电极方程式为O2+4H++4e-═2H2O,以此解答该题.
解答 解:A.由电极方程式O2+4H++4e-═2H2O可知,每有0.1mol O2反应,则迁移H+0.4mol,故A正确;
B.充电时,不能生成乙烯和氧气,不是充电电池,故B错误;
C.电子只能经过导线,不能经过溶液,故C错误;
D.正极发生还原反应,电极方程式为O2+4H++4e-═2H2O,负极为CH2=CH2-2e-+H2O=CH3CHO+2H+,故D错误.
故选A.
点评 本题考查了原电池原理的应用,为高频考点,注意掌握电极方程式的书写是解决本题的关键,易错点为C,注意电子不能流经溶液,题目难度中等.

练习册系列答案
相关题目
8.实验室用锌粒与2mol•L-1硫酸溶液制取氢气,下列措施能增大化学反应速率的是( )
| A. | 加入CH3COONa溶液 | B. | 改用3 mol•L-1盐酸 | ||
| C. | 用锌粉代替锌粒 | D. | 加入少量铜粉 |
9.下列措施中,能加快化学反应速率的是( )
| A. | 食物储存在冰箱里 | |
| B. | 向H2O2溶液中加入MnO2 | |
| C. | 用块状碳酸钙代替粉末状碳酸钙与稀盐酸反应 | |
| D. | 用0.1 mol/L H2SO4溶液代替1 mol/L H2SO4溶液与锌粒反应 |
12.某种快速充电电池的电极材料分别为锂和石墨,电解液是LiAlCl4-SOCl2.电池的总反应可表示为:4LiCl+S+SO2$?_{放电}^{充电}$4Li+2SOCl2.下列说法正确的是( )
| A. | 该电池放电时,负极材料为锂,发生还原反应 | |
| B. | 组装该电池可以在有氧的条件下进行 | |
| C. | 电池放电时电子从负极经外电路流向正极,再从正极经电解液流向负极 | |
| D. | 电池充电时阳极反应式为:4Cl-+S+SO2-4e-=2SOCl2 |
16.水溶液中能大量共存的一组离子是( )
| A. | K+、Al3+、NO3-、HCO3- | B. | H+、Na+、Fe2+、ClO- | ||
| C. | Na+、Ba2+、Cl-、NO3- | D. | K+、NH4+、SO42-、OH- |
13.下列物质性质与应用对应关系正确的是( )
| A. | 液氨汽化时吸收大量的热,可用作制冷剂 | |
| B. | 硅酸钠溶液呈碱性,可用作木材防火剂 | |
| C. | NaHCO3能与碱反应,可用作焙制糕点的膨松剂 | |
| D. | Fe比Cu活泼,可用FeCl3溶液腐蚀线路板上的Cu |
14.如图是部分短周期主族元素原子半径与原子序数的关系图.则下列说法正确的是( )
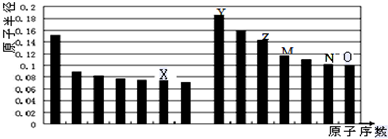

| A. | Y、O两种元素的离子半径相比,前者较大 | |
| B. | Z的氧化物能分别溶解于Y的最高氧化物的水化物和O的氢化物的水溶液 | |
| C. | 由X与Y两种元素组成的化合物只含离子键 | |
| D. | X、N两种元素的气态氢化物的稳定性相比,后者较强 |

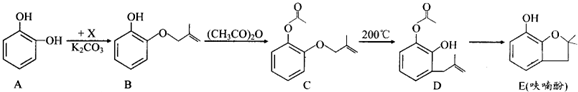
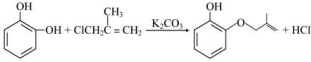 ;
; ;
;