题目内容
2.W、X、Y、Z是四种短周期元素,其原子序数依次增大.已知甲是由其中三种元素组成的化合物,25℃时0.1mo1.L-1甲溶液的pH为13.X元素的气态氢化物可与其最高价氧化物对应的水化物反应生成盐.下列说法中,正确的是( )| A. | 原子半径大小的比较:r(X)>r(Y)>r(Z) | |
| B. | 元素Y、Z的简单离子的电子层结构不同 | |
| C. | 元素X的简单气态氢化物的热稳定性比元素Y的强 | |
| D. | 只含W、X、Y三种元素的化合物中,有离子化合物,也有共价化合物 |
分析 W、X、Y、Z是四种短周期元素,其原子序数依次增大,甲是由其中三种元素组成的化合物,25℃时0.1mo1.L-1甲溶液的pH为13,则甲为强碱,即NaOH,所以W为H元素,Y为O元素,Z为Na元素;X元素的气态氢化物可与其最高价氧化物对应的水化物反应生成盐,则X为N元素,然后结合元素化合物性质及元素周期律来解答.
解答 解:W、X、Y、Z是四种短周期元素,其原子序数依次增大,甲是由其中三种元素组成的化合物,25℃时0.1mo1.L-1甲溶液的pH为13,则甲为强碱,即NaOH,所以W为H元素,Y为O元素,Z为Na元素;X元素的气态氢化物可与其最高价氧化物对应的水化物反应生成盐,则X为N元素,
A.电子层数越多半径越大,电子层数相同时,原子序数越大,半径越小,则r(Z)>r(X)>r(Y),故A错误;
B.Y为O元素,Z为Na元素,其简单离子均有10个电子,电子层结构相同,故B错误;
C.非金属性:X<Y,则元素X的简单气态氢化物的热稳定性比元素Y的弱,故C错误;
D.只含W、X、Y三种元素的化合物中,有离子化合物如NH4NO3,也有共价化合物HNO3,故D正确;
故选D.
点评 本题考查原子结构与元素周期律知识,题目难度不大,根据题中信息判断元素在周期表中的位置,结合元素周期律的递变规律进行判断.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
12.某种快速充电电池的电极材料分别为锂和石墨,电解液是LiAlCl4-SOCl2.电池的总反应可表示为:4LiCl+S+SO2?充电放电4Li+2SOCl2.下列说法正确的是( )
| A. | 该电池放电时,负极材料为锂,发生还原反应 | |
| B. | 组装该电池可以在有氧的条件下进行 | |
| C. | 电池放电时电子从负极经外电路流向正极,再从正极经电解液流向负极 | |
| D. | 电池充电时阳极反应式为:4Cl-+S+SO2-4e-=2SOCl2 |
13.下列物质性质与应用对应关系正确的是( )
| A. | 液氨汽化时吸收大量的热,可用作制冷剂 | |
| B. | 硅酸钠溶液呈碱性,可用作木材防火剂 | |
| C. | NaHCO3能与碱反应,可用作焙制糕点的膨松剂 | |
| D. | Fe比Cu活泼,可用FeCl3溶液腐蚀线路板上的Cu |
10.短周期主族元素X、Y、Z、W、M的原子序数依次增大,其中Y和W的原子序数相差8,W原子最外层电子数是Z原子最外层电子数的2倍,Y、Z、W三种原子的最外层电子数之和为15,X的最高正价和最低负价的代数和为0.下列说法正确的是( )
| A. | 原子半径的大小顺序:r(W)>r(Z)>r(Y) | |
| B. | 元素Z、M的简单离子的电子层结构相同 | |
| C. | W的简单气态氢化物的热稳定性比M的差 | |
| D. | 元素X和Y形成的化合物只有一种 |
7.在工农业生产和科学研究中,许多重要的化学反应需要在水溶液中进行,试分析并回答以下问题:
(1)向体积均为20.00mL、浓度均为0.1mol•L-1盐酸和醋酸溶液中分别滴加0.1mol•L-1NaOH溶液.随加入的NaOH溶液体积的增加,溶液pH的变化如图所示:
①用NaOH溶液滴定醋酸溶液的曲线是I(填“I”或“Ⅱ”);
②实验前,上述三种溶液中由水电离出的c(H+)最大的是CH3COOH溶液(填化学式);
③图中V1和V2大小的比较:V1< V2 (填“>”、“<”或“=”);
④图I中M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) (用离子的物质的量浓度符号填空).
(2)为了研究沉淀溶解平衡,某同学查阅资料并设计了如下实验(相关数据测定温度及实验环境均为25℃):资料:AgSCN是白色沉淀;Ksp(AgSCN)=1.0×10-12;Ksp(AgI)=8.5×10-17
①步骤2中溶液变红色,说明溶液中存在SCN-,该离子经过步骤1中的反应,在溶液中仍然存在,原因是:由于存在沉淀溶解平衡AgSCN(s)?Ag+(aq)+SCN-(aq),溶液中仍有少量SCN-(用必要的文字和方程式说明);
②该同学根据步骤3中现象a推知,加入的AgNO3与步骤2所得溶液发生了反应,则现象a为出现白色沉淀;溶液红色变浅(至少答出两条明显现象);
③写出步骤4中沉淀转化反应平衡常数的表达式:K=c(SCN−)c(I).
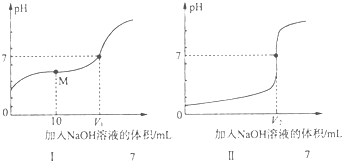
(1)向体积均为20.00mL、浓度均为0.1mol•L-1盐酸和醋酸溶液中分别滴加0.1mol•L-1NaOH溶液.随加入的NaOH溶液体积的增加,溶液pH的变化如图所示:
①用NaOH溶液滴定醋酸溶液的曲线是I(填“I”或“Ⅱ”);
②实验前,上述三种溶液中由水电离出的c(H+)最大的是CH3COOH溶液(填化学式);
③图中V1和V2大小的比较:V1< V2 (填“>”、“<”或“=”);
④图I中M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) (用离子的物质的量浓度符号填空).
(2)为了研究沉淀溶解平衡,某同学查阅资料并设计了如下实验(相关数据测定温度及实验环境均为25℃):资料:AgSCN是白色沉淀;Ksp(AgSCN)=1.0×10-12;Ksp(AgI)=8.5×10-17
| 操作步骤 | 现象 |
| 步骤1:向2mL 0.005mol•L-1 AgNO3溶液中加入2mL 0.005mol•L-1KSCN溶液,静置. | 出现白色沉淀. |
| 步骤2:取1mL上层清液于试管中,滴加1滴2mol•L-1 Fe(NO3)3溶液. | 溶液变红色. |
| 步骤3:向步骤2的溶液中,继续加入5滴3mol•L-1AgNO3溶液. | 出现白色沉淀,溶液红色变浅. |
| 步骤4:向步骤1余下的浊液中加入5滴3mol•L-1KI溶液. | 出现黄色沉淀. |
②该同学根据步骤3中现象a推知,加入的AgNO3与步骤2所得溶液发生了反应,则现象a为出现白色沉淀;溶液红色变浅(至少答出两条明显现象);
③写出步骤4中沉淀转化反应平衡常数的表达式:K=c(SCN−)c(I).

14.如图是部分短周期主族元素原子半径与原子序数的关系图.则下列说法正确的是( )
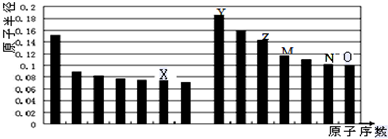

| A. | Y、O两种元素的离子半径相比,前者较大 | |
| B. | Z的氧化物能分别溶解于Y的最高氧化物的水化物和O的氢化物的水溶液 | |
| C. | 由X与Y两种元素组成的化合物只含离子键 | |
| D. | X、N两种元素的气态氢化物的稳定性相比,后者较强 |
11.某硝酸钠固体中混有少量硫酸铵和碳酸氢钠杂质,现设计一实验方案,既除去杂质,又配成硝酸钠溶液.实验方案:先将固体溶于蒸馏水配成溶液,选择合适的试剂和操作完成表格中各步实验.下列试剂或操作不合理的是( )
| 选择试剂 | ① | Na2CO3溶液 | ④ |
| 实验操作 | ② | ③ | 加热 |
| A. | 试剂①为Ba(OH)2溶液 | B. | 操作②为结晶 | ||
| C. | 操作③为过滤 | D. | 试剂④为稀HNO3 |
12.现有部分短周期元素相关信息如下表所示:
(1)四种元素原子半径由大到小的顺序为Y>Z>X>T(用T、X、Y、Z表示).M中所含化学键的类型为离子键、共价键.
(2)若Z的单质及R在光伏电池产业、现代通讯产业中占据极为重要的位置,则R与M反应的离子方程式为SiO2+2OH-=SiO32-+H2O.若Z能形成稳定的单核离子,则请举例说明Z的金属性比Y的金属性弱:NaOH的碱性比Al(OH)3强.
(3)元素T与氢元素可形成原子个数比为1:1的化合物Q,元素X与氢元素可形成原子个数比为1:2的化合物W,W常用作发射火箭的燃料,Q与W按物质的量比为2:1的比例恰好反应生成X的单质和T的另一种氢化物,写出该反应的化学方程式2H2O2+N2H4=N2↑+4H2O.
| 元素 | T | X | Y | Z |
| 信息 | 原子最外层电子数比内层电子数多4 | 最高正价为+5,单质性质很稳定 | L层电子数比其他电子层电子数之和多5 | 单质、最高价氧化物(R)及对应的水化物均可与Y的最高价氧化物对应的水化物(M)反应 |
(2)若Z的单质及R在光伏电池产业、现代通讯产业中占据极为重要的位置,则R与M反应的离子方程式为SiO2+2OH-=SiO32-+H2O.若Z能形成稳定的单核离子,则请举例说明Z的金属性比Y的金属性弱:NaOH的碱性比Al(OH)3强.
(3)元素T与氢元素可形成原子个数比为1:1的化合物Q,元素X与氢元素可形成原子个数比为1:2的化合物W,W常用作发射火箭的燃料,Q与W按物质的量比为2:1的比例恰好反应生成X的单质和T的另一种氢化物,写出该反应的化学方程式2H2O2+N2H4=N2↑+4H2O.
 达喜[AlaMgb(OH)c(CO3)d•xH2O]常用于中和胃酸.
达喜[AlaMgb(OH)c(CO3)d•xH2O]常用于中和胃酸.