题目内容
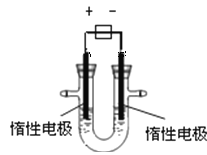
【题目】某学校实验小组欲探究硫粉与铁粉的反应,并验证反应后的产物中铁元素的化合价,如图是铁粉和硫粉反应的装置图。
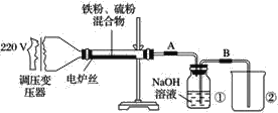
(1)将硫粉和铁粉按物质的量之比1∶1充分混合。
(2)按装置图将仪器连接好。
(3)____________。
(4)将混合物均匀地放在硬质玻璃管内。
(5)接通电源,将电压指示盘调到35 V,电炉丝很快变红,并引发左边混合物发生反应。关闭电源。
(6)将反应后的混合物冷却后加入稀硫酸中,然后取上层清液滴加硫氰酸钾溶液验证产物中铁元素的化合价。
(思考探究)
(1)步骤(3)中缺少的实验操作是什么?____。
(2)关闭电源后,反应仍继续进行的原因是什么?_____________。
(3)将盛有NaOH溶液的瓶中A、B导管位置反接是否可以?为什么?______________。
(4)某同学认为,若Fe粉与S粉反应产物中铁元素的化合价是+2价,则上述步骤(6)中的溶液不变红,你认为他的说法正确吗?__________________。
【答案】检查装置的气密性 Fe粉与S粉反应是放热的,且放出的热量能使反应继续进行至反应完全 不可以,若反接会使NaOH溶液回流至未完全冷却的玻璃管中,而使玻璃管炸裂 不正确,因为反应未隔绝空气,空气中的O2参与反应会干扰实验结果
【解析】
(1)密闭环境中发生反应前,都需检验装置是否漏气。
(2)关闭电源后,反应仍继续进行,说明反应能继续提供反应时所需的热量。
(3)将盛有NaOH溶液的瓶中A、B导管位置反接,则会导致在反应结束、反应装置内压强减小时,产生倒吸。
(4)Fe2+ 具有较强的还原性,能被空气中的O2氧化为Fe3+。
(1)从以上分析可知,步骤(3)中缺少的实验操作是检查装置的气密性。答案为:检查装置的气密性;
(2)关闭电源后,反应仍继续进行,说明Fe粉与S粉反应是放热的,且放出的热量能使反应继续进行至反应完全。答案为:Fe粉与S粉反应是放热的,且放出的热量能使反应继续进行至反应完全;
(3)将盛有NaOH溶液的瓶中A、B导管位置反接,此操作不可以,因为若反接会使NaOH溶液回流至未完全冷却的玻璃管中,而使玻璃管炸裂。答案为:不可以,若反接会使NaOH溶液回流至未完全冷却的玻璃管中,而使玻璃管炸裂;
(4)某同学认为,若Fe粉与S粉反应产物中铁元素的化合价是+2价,则上述步骤(6)中的溶液不变红,他的说法不正确,因为反应未隔绝空气,空气中的O2参与反应会干扰实验结果。答案为:不正确,因为反应未隔绝空气,空气中的O2参与反应会干扰实验结果。

 同步练习强化拓展系列答案
同步练习强化拓展系列答案【题目】下列各组中离子在水溶液中能大量共存且满足相应要求的是( )
选项 | 离子 | 要求 |
A | K+、NO | c(K+)<c(Cl-) |
B | Na+、NO | 逐滴滴加盐酸立即有气体产生 |
C | Na+、Al3+、Mg2+、SO | 逐滴滴加氨水立即有沉淀产生 |
D | NH | 滴加NaOH浓溶液立刻有气体产生 |
A.AB.BC.CD.D