题目内容
【题目】目前很多工厂实现了烟气的脱硫脱硝和氨氮废水的无害化处理,回答下列问题:
(1)某小组同学在实验室里尝试模拟工厂处理氨氮废水(主要含NH![]() )的不同方法,过程如下:①甲同学采用Ca(ClO)2作为氧化剂。将废水中的NH
)的不同方法,过程如下:①甲同学采用Ca(ClO)2作为氧化剂。将废水中的NH![]() 转化为无毒气体。他在实验中发现其他条件相同时,Ca(ClO)2的浓度越大碱性越强,处理后的废水中亚硝酸盐(NO
转化为无毒气体。他在实验中发现其他条件相同时,Ca(ClO)2的浓度越大碱性越强,处理后的废水中亚硝酸盐(NO![]() )的浓度也随之变大,写出该反应的离子方程式:___。
)的浓度也随之变大,写出该反应的离子方程式:___。
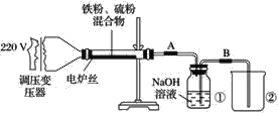
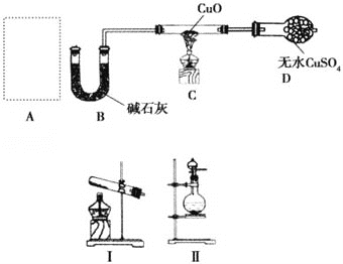
②乙同学在实验室模拟工业上的“吹脱法”测定废水的含氮量,设计了以下实验:精确称取wg废水样品,注入如所图示的仪器中,然后逐滴加入足量10%NaOH溶液,通入水蒸气。将样品液中的氨全部蒸出,用V1mLc1mol·L-1盐酸标准溶液吸收。蒸氨结束后取下接收瓶,用c2molL-1NaOH标准溶液滴定过剩的HCl,到终点时消耗V2mLNaOH溶液。

NH4Cl的电子式为___。盛放样品液的仪器是___(填名称);圆底烧瓶中长玻璃导管的作用是___;冰盐水的作用是___。
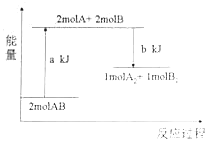
(2)某工厂利用NaClO2/(NH4)2CO3溶液脱除烟气中的SO2和NO。①保持溶液中NaClO2的浓度不变,研究(NH4)2CO3的浓度对NO和SO2脱除效率的影响[已知:(NH4)2CO3溶液显碱性;NaClO2的氧化性随pH增加而下降,酸性条件下会生成ClO2]。实验结果如图所示,随着(NH4)2CO3溶液浓度的增大造成NO脱除效率下降的主要原因是___。

②NO脱除效率总是小于SO2脱除效率的主要原因是___。(写出一点)
(3)某工厂采用微生物硝化法处理氨氮废水,过程如图:

下列有关说法正确的是___(填标号)。
①微生物硝化法处理废水后会导致水体的pH升高
②若微生物保持活性的pH范围为7~9,则适宜用来调节水体pH的是CO2
③不能采用电解法在阴极将NH![]() 直接转化为NO
直接转化为NO![]()
【答案】3ClO-+NH![]() +2OH-=NO
+2OH-=NO![]() +3Cl-+3H2O
+3Cl-+3H2O  三颈烧瓶 当烧瓶中压力过大时,安全管中液面上升,使烧瓶中压力稳定(或平衡气压) 冷却降温,防止反应放热使盐酸挥发(或降温有利于氨气的吸收) (NH4)2CO3浓度增加,溶液的碱性越强,NaClO2的氧化性下降 NO的溶解度较低(或脱硝反应的活化能较高) ③
三颈烧瓶 当烧瓶中压力过大时,安全管中液面上升,使烧瓶中压力稳定(或平衡气压) 冷却降温,防止反应放热使盐酸挥发(或降温有利于氨气的吸收) (NH4)2CO3浓度增加,溶液的碱性越强,NaClO2的氧化性下降 NO的溶解度较低(或脱硝反应的活化能较高) ③
【解析】
(1)①Ca(ClO)2的浓度越大碱性越强,处理后的废水中亚硝酸盐(NO![]() )的浓度也随之变大,说明NH
)的浓度也随之变大,说明NH![]() 被氧化成NO
被氧化成NO![]() ,该反应的离子方程式:3ClO-+NH
,该反应的离子方程式:3ClO-+NH![]() +2OH-=NO
+2OH-=NO![]() +3Cl-+3H2O。故答案为:3ClO-+NH
+3Cl-+3H2O。故答案为:3ClO-+NH![]() +2OH-=NO
+2OH-=NO![]() +3Cl-+3H2O;
+3Cl-+3H2O;
②NH4Cl是离子化合物,电子式为 。盛放样品液的仪器是三颈烧瓶;圆底烧瓶中长玻璃导管的作用是当烧瓶中压力过大时,安全管中液面上升,使烧瓶中压力稳定(或平衡气压);冰盐水的作用是冷却降温,防止反应放热使盐酸挥发(或降温有利于氨气的吸收)。故答案为:
。盛放样品液的仪器是三颈烧瓶;圆底烧瓶中长玻璃导管的作用是当烧瓶中压力过大时,安全管中液面上升,使烧瓶中压力稳定(或平衡气压);冰盐水的作用是冷却降温,防止反应放热使盐酸挥发(或降温有利于氨气的吸收)。故答案为: ;三颈烧瓶;当烧瓶中压力过大时,安全管中液面上升,使烧瓶中压力稳定(或平衡气压);冷却降温,防止反应放热使盐酸挥发(或降温有利于氨气的吸收);
;三颈烧瓶;当烧瓶中压力过大时,安全管中液面上升,使烧瓶中压力稳定(或平衡气压);冷却降温,防止反应放热使盐酸挥发(或降温有利于氨气的吸收);
(2)①已知:(NH4)2CO3溶液显碱性,NaClO2的氧化性随pH增加而下降,酸性条件下会生成ClO2,根据图中实验结果,随着(NH4)2CO3溶液浓度的增大,造成NO脱除效率下降的主要原因是:(NH4)2CO3浓度增加,溶液的碱性越强,NaClO2的氧化性下降。故答案为:(NH4)2CO3浓度增加,溶液的碱性越强,NaClO2的氧化性下降;
②根据NO的性质,NO脱除效率总是小于SO2脱除效率的主要原因是:NO的溶解度较低(或脱硝反应的活化能较高)。故答案为:NO的溶解度较低(或脱硝反应的活化能较高);
(3)采用微生物硝化法处理氨氮废水,由图可得反应:NH4++2O2=NO3-+H2O+2H+,
①微生物硝化法处理废水后会导致水体的pH降低,故错误;
②若微生物保持活性的pH范围为7~9,调节水体pH可加入碱性物质,但不能引入新杂质,且加强碱易使微生物变性,可加入石灰石来调节水体的pH,故B错误;
③电解时,阳极发生氧化反应,不能采用电解法在阴极将NH![]() 直接转化为NO
直接转化为NO![]() ,故正确;
,故正确;
故答案为:③。

【题目】CO2是地球上取之不尽用之不竭的碳源,将CO2应用于生产中实现其综合利用是目前的研究热点。
(1)CO2加氢制备甲酸(HCOOH,熔点8.4℃沸点100.8℃)是利用化学载体进行H2储存的关键步骤。
已知:H2(g)+CO2(g)![]() HCOOH(l) △H1=-30.0kJmol-1
HCOOH(l) △H1=-30.0kJmol-1
2H2(g)+O2(g)=2H2O(1) △H2=-571.6kJmol-1
则表示HCOOH燃烧热的热化学方程式为___。
(2)在催化作用下由CO2和CH4转化为CH3COOH的反应历程示意图如图。
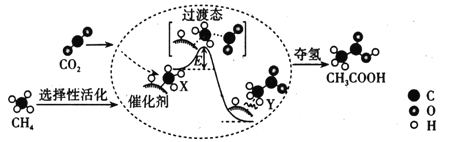
①在合成CH3COOH的反应历程中,下列有关说法正确的是___。填(字母)
a.该催化剂使反应的平衡常数增大
b.CH4→CH3COOH过程中,有C—H键发生断裂
c.由X→Y过程中放出能量并形成了C—C键
②该条件下由CO2和CH4合成CH3COOH的化学方程式为___。
(3)CO2与H2在一定条件下反应可生成甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H<0。改变温度时,该反应中的所有物质都为气态,起始温度、容积均相同(T1℃、2L密闭容器)。实验过程中的部分数据见下表:
CH3OH(g)+H2O(g) △H<0。改变温度时,该反应中的所有物质都为气态,起始温度、容积均相同(T1℃、2L密闭容器)。实验过程中的部分数据见下表:
反应时间 | n(CO2)/mol | n(H2)/mol | n(CH3OH)/mol | n(H2O)/mol | |
实验I恒温恒容 | 0min | 2 | 6 | 0 | 0 |
10min | 4.5 | ||||
20min | 1 | ||||
30min | 1 | ||||
实验II绝热恒容 | 0min | 0 | 0 | 2 | 2 |
①实验I,前10min内的平均反应速率υ(CH3OH)=___。
②平衡时CH3OH的浓度:c(实验I)___c(实验II)(填“>”、“<”或“=”,下同)。实验I中当其他条件不变时,若30min后只改变温度为T2℃,再次平衡时n(H2)=3.2mol,则T1___T2。
③已知某温度下该反应的平衡常数K=160,开始时在密闭容器中只加入CO2和H2,反应10min时测得各组分的浓度如下表,则此时υ正___υ逆。
物质 | H2 | CO2 | CH3OH | H2O |
浓度/(mol·L-1) | 0.2 | 0.2 | 0.4 | 0.4 |