��Ŀ����
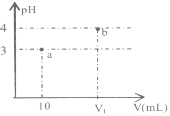
����Ŀ����1���ö��Ե缫���CuSO4��Һ����ͼ��װ�ã���

�ù����е��ص缫��ӦʽΪ�������� �� ������ ��
��2����������װ��������Һ������������3.2gʱ��ֹͣͨ�磬��ʱ��������������������״����Ϊ ����������ȫ���ݳ�����
��3����ʹ���Һ�ָ�����ʼ״̬��Ӧ����Һ�м���������
A��CuSO4 B��H2O C��CuO D��CuSO4��5H2O

��4����Na2CO3������������ʣ�CO��O2Ϊԭ����ɵ����͵�ص��о�ȡ�����ش�ͻ�ơ��õ��ʾ��ͼ���ң������缫��ӦʽΪ_________________________��Ϊ��ʹ��ȼ�ϵ�س�ʱ���ȶ����У���صĵ�������Ӧ�����ȶ�����ع���ʱ�����в���A���ʲμ�ѭ����A���ʵĻ�ѧʽΪ__________________��
���𰸡���1��4OH-=O2+2H2O+4e- 2Cu2++4 e- = 2Cu ��2��0.56L
��3��C ��4��CO32-+CO![]() 2CO2+2e�� CO2
2CO2+2e�� CO2
��������
�����������1���ö��Ե缫�������ͭ��Һʱ�����������������ӷŵ����缫��ӦʽΪ��4OH-=O2+2H2O+4e-��������ͭ���ӷŵ����缫��ӦʽΪ��2Cu2++4 e- = 2Cu ��
��2����������3.2g��ӦΪͭ��������ͭ���ʵ���Ϊn=3.2g��64g/mol=0.05 mol��ת�Ƶĵ���Ϊ0.05mol �� 2 = 0.1mol���������缫ת�Ƶĵ�����Ŀ��ȣ�������ת�Ƶĵ���ҲΪ0.1mol�����������������������ʵ���Ϊ0.1mol��4=0.025mol���ų������ڱ�״���µ����Ϊ0.025mol��22.4L/mol=0.56L��
��3������Һ��������������������ͭ����Ϊϡ�����������ͭ������Ӧ����������ͭ��Ӧ��������ͭ��Ӧ��������ͭ����������Һ�м�������ͭ���ɣ���ѡC��
��4����ȼ�ϵ�ص��ܷ�ӦΪ��2CO+O2=2CO2��ͨ��������CO2�Ļ������һ��Ϊԭ��ص�������������ԭ��Ӧ���缫��ӦʽΪ��O2+4e-+2CO2=2CO32-��ͨ��CO��һ��Ϊԭ��صĸ���������������Ӧ���缫��ӦʽΪ��CO32-+CO![]() 2CO2+2e�������ݵ缫��Ӧ��֪����������CO2���壬����������CO2���壬���Ե�ع���ʱ�����в��ֶ�����̼�μ�ѭ������A���ʵĻ�ѧʽΪCO2��
2CO2+2e�������ݵ缫��Ӧ��֪����������CO2���壬����������CO2���壬���Ե�ع���ʱ�����в��ֶ�����̼�μ�ѭ������A���ʵĻ�ѧʽΪCO2��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
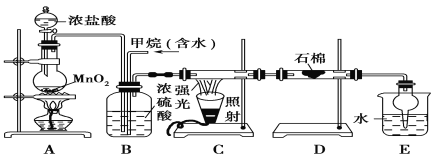
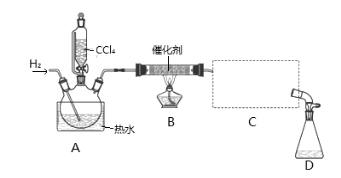
Сѧ��10����Ӧ����ϵ�д�����Ŀ���ȷ£�CHCl3���������л��ܼ������������������ڿ������ױ�������ʵ�����п����Ȼ�ԭCCl4���Ʊ��ȷ£�װ��ʾ��ͼ���й��������£�
���� | ��Է������� | �ܶ�/(g��mL-1) | �е�/�� | ˮ���ܽ��� |
CHCl3 | 119.5 | 1.50 | 61.3 | ���� |
CCl4 | 154 | 1.59 | 76.7 | ���� |
ʵ�鲽�裺
�ټ���װ�������ԣ��ڿ�ʼͨ��H2�� �۵�ȼB���ƾ��ƣ�
����A��ˮ���м�����ˮ����ͨC������װ�õ���ˮ; ��������ƿ�е���20 mLCCl4��
��Ӧ������ֹͣ���ȣ���D����ƿ���ռ�����Һ��ֱ�������NaHCO3��Һ��ˮϴ�ӣ��ֳ��IJ������������ˮCaCl2���壬���ú���ˣ�
�߶���Һ�����������õ��ȷ�15 g����ش�
��1��������ںͲ���۵�˳��ߵ�����ʵ���в����IJ����������Ϊ ��
��2��B���з�����Ҫ��Ӧ�Ļ�ѧ����ʽΪ ��
��3��C����Ӧѡ�õ�������Ϊ ����ѡ����ĸ������ˮӦ�Ӹ������ܵ� ���a����b�����ڽ��롣
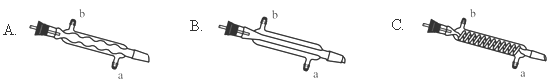
��4��������У���ˮϴ�ӵ�Ŀ��Ϊ ��
��5����ʵ���У��ȷµIJ���Ϊ ��
��6���ȷ��ڿ������ܱ�������������HCl������COCl2�����÷�Ӧ�Ļ�ѧ����ʽΪ ��