题目内容
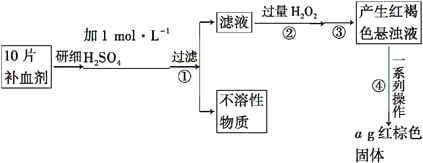
【题目】某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶19.2 g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示。下列分析或结果不正确的是( )

A.图中,AB段的反应为Fe+2Fe3+=3Fe2+,溶液中溶质最终为硫酸亚铁
B.原溶液中硫酸浓度为2.5 mol·L-1
C.原混合溶液中硝酸根离子的物质的量为0.2 mol
D.图中,OA段产生的气体是一氧化氮,BC段产生的气体是氢气
【答案】BC
【解析】
由题意可知金属铜的物质的量为![]() =0.3mol,由铜和硝酸反应的方程式3Cu+8H++2NO3—=3Cu2++2NO↑+4H2O可知,溶液中硝酸根离子的物质的量=0.3mol×
=0.3mol,由铜和硝酸反应的方程式3Cu+8H++2NO3—=3Cu2++2NO↑+4H2O可知,溶液中硝酸根离子的物质的量=0.3mol×![]() =0.2mol;由图可知OA段发生的反应为:Fe+4H++NO3—=Fe3++NO↑+2H2O, AB段发生的反应为:2Fe3++Fe=Fe2+,BC段发生的反应为:Fe+2H+=Fe2++H2↑。
=0.2mol;由图可知OA段发生的反应为:Fe+4H++NO3—=Fe3++NO↑+2H2O, AB段发生的反应为:2Fe3++Fe=Fe2+,BC段发生的反应为:Fe+2H+=Fe2++H2↑。
A项、由图可知,OA段为铁与溶液中硝酸根反应、AB段为铁离子与铁反应、BC段为氢离子与铁反应,溶液中硝酸根全部转化为NO,最终得到硫酸亚铁溶液,故A正确;
B项、由图可知溶液中亚铁离子的物质的量为![]() =0.4mol,由电荷守恒可知,溶液中硫酸根的物质的量为0.4mol,则原溶液中硫酸浓度为
=0.4mol,由电荷守恒可知,溶液中硫酸根的物质的量为0.4mol,则原溶液中硫酸浓度为![]() =4mol/L,故B错误;
=4mol/L,故B错误;
C项、金属铜的物质的量为![]() =0.3mol,由铜和硝酸反应的方程式3Cu+8H++2NO3—=3Cu2++2NO↑+4H2O可知,溶液中硝酸根离子的物质的量=0.3mol×
=0.3mol,由铜和硝酸反应的方程式3Cu+8H++2NO3—=3Cu2++2NO↑+4H2O可知,溶液中硝酸根离子的物质的量=0.3mol×![]() =0.2mol,则原溶液硝酸根离子的物质的量为0.2 mol×2=0.4mol,故C错误;
=0.2mol,则原溶液硝酸根离子的物质的量为0.2 mol×2=0.4mol,故C错误;
D项、由图可知OA段发生的反应为:Fe+4H++NO3—=Fe3++NO↑+2H2O, AB段发生的反应为:2Fe3++Fe=Fe2+,BC段发生的反应为:Fe+2H+=Fe2++H2↑,则OA段产生的气体是一氧化氮,BC段产生的气体是氢气,故D正确;
故选BC。

【题目】近年来,全国部分地区被雾霾笼罩,机动车尾气排放成为引发雾霾的罪魁祸首。提高空气质量,减少机动车尾气排放成为当务之急。汽车内燃机工作时引起反应:N2(g)+O2(g) ![]() 2NO(g),是导致汽车尾气中含有NO的原因之一。已知断裂某些共价键需要的能量如表:
2NO(g),是导致汽车尾气中含有NO的原因之一。已知断裂某些共价键需要的能量如表:
断裂的共价键 | O =O | N≡N | N—O |
需要的能量 | 495 kJ·mol-1 | 945 kJ·mol-1 | 630 kJ·mol-1 |
(1)机动车发动机工作时会引发N2和O2的反应,该反应是____(填“放热”或“吸热”)反应,1 molO2与1 molN2的总能量比2 molNO的总能量___(填“大”或“小”)。
(2)N2与O2合成NO的热化学方程式可以表示为![]() N2(g)+
N2(g)+![]() O2(g)=NO(g)ΔH,则ΔH=_____。
O2(g)=NO(g)ΔH,则ΔH=_____。
(3)NO与CO反应的热化学方程式可以表示为2NO(g)+2CO(g)=2CO2(g)+N2(g) ΔH=a kJ·mol-1,但该反应的速率很小,若使用机动车尾气催化转化器,尾气中的NO与CO可以转化成无害物质排出。上述反应在使用“催化转化器”后,a___(填“增大”“减小”或“不变”)。
(4)已知:①Fe(s)+![]() O2(g)=FeO(s) ΔH1=-275.0 kJ·mol-1;
O2(g)=FeO(s) ΔH1=-275.0 kJ·mol-1;
②2Al(s)+![]() O2(g)=Al2O3(s) ΔH2=-1 675.0 kJ·mol-1。
O2(g)=Al2O3(s) ΔH2=-1 675.0 kJ·mol-1。
Al和FeO发生铝热反应的热化学方程式是_______。
【题目】CO2是地球上取之不尽用之不竭的碳源,将CO2应用于生产中实现其综合利用是目前的研究热点。
(1)CO2加氢制备甲酸(HCOOH,熔点8.4℃沸点100.8℃)是利用化学载体进行H2储存的关键步骤。
已知:H2(g)+CO2(g)![]() HCOOH(l) △H1=-30.0kJmol-1
HCOOH(l) △H1=-30.0kJmol-1
2H2(g)+O2(g)=2H2O(1) △H2=-571.6kJmol-1
则表示HCOOH燃烧热的热化学方程式为___。
(2)在催化作用下由CO2和CH4转化为CH3COOH的反应历程示意图如图。
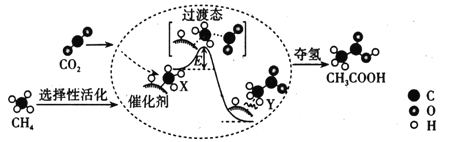
①在合成CH3COOH的反应历程中,下列有关说法正确的是___。填(字母)
a.该催化剂使反应的平衡常数增大
b.CH4→CH3COOH过程中,有C—H键发生断裂
c.由X→Y过程中放出能量并形成了C—C键
②该条件下由CO2和CH4合成CH3COOH的化学方程式为___。
(3)CO2与H2在一定条件下反应可生成甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H<0。改变温度时,该反应中的所有物质都为气态,起始温度、容积均相同(T1℃、2L密闭容器)。实验过程中的部分数据见下表:
CH3OH(g)+H2O(g) △H<0。改变温度时,该反应中的所有物质都为气态,起始温度、容积均相同(T1℃、2L密闭容器)。实验过程中的部分数据见下表:
反应时间 | n(CO2)/mol | n(H2)/mol | n(CH3OH)/mol | n(H2O)/mol | |
实验I恒温恒容 | 0min | 2 | 6 | 0 | 0 |
10min | 4.5 | ||||
20min | 1 | ||||
30min | 1 | ||||
实验II绝热恒容 | 0min | 0 | 0 | 2 | 2 |
①实验I,前10min内的平均反应速率υ(CH3OH)=___。
②平衡时CH3OH的浓度:c(实验I)___c(实验II)(填“>”、“<”或“=”,下同)。实验I中当其他条件不变时,若30min后只改变温度为T2℃,再次平衡时n(H2)=3.2mol,则T1___T2。
③已知某温度下该反应的平衡常数K=160,开始时在密闭容器中只加入CO2和H2,反应10min时测得各组分的浓度如下表,则此时υ正___υ逆。
物质 | H2 | CO2 | CH3OH | H2O |
浓度/(mol·L-1) | 0.2 | 0.2 | 0.4 | 0.4 |