题目内容
【题目】将7.68g铜与50mL一定浓度的硝酸恰好完全反应,收集到标准状况下4.48L气体。
请回答:
(1)NO的体积为__L,NO2的体积为__L;
(2)被还原的硝酸的物质的量是__mol;
(3)硝酸的物质的量浓度是__mol·L-1。
【答案】0.448 4.032 0.2 8.8
【解析】
根据铜与浓硝酸反应生成硝酸铜、二氧化氮和水及铜与稀硝酸反应生成硝酸铜、一氧化氮和水的方程式进行计算。
n(Cu)=![]() =0.12mol,n(NO)+n(NO2)=
=0.12mol,n(NO)+n(NO2)=![]() =0.2mol;
=0.2mol;
(1)Cu~~~~~Cu2+~~~~~2e-
0.12mol 0.24mol
HNO3~~~NO2↑~~e- HNO3~~~NO↑~~3e-
n(NO2) n(NO2) n(NO) 3 n(NO)
由得失电子守恒得:3n(NO)+n(NO2)=0.24mol;又因n(NO)+n(NO2)=0.2mol,解得n(NO2)=0.18mol,n(NO)=0.02mol,即V(NO2)=4.032L,V(NO)=0.448L;
(2)HNO3被还原生成NO和NO2,故被还原的n(HNO3)=n(NO2)+n(NO)=0.2mol;
(3)参加反应的HNO3部分生成Cu(NO3)2,部分做氧化剂被还原,
故n(HNO3)=2n(Cu)+[n(NO2)+n(NO)]=0.44mol,则c(HNO3)=![]() =
=![]() =8.8mol/L。
=8.8mol/L。

【题目】I.氮是地球上含量丰富的一种元素,氨、肼(N2H4)、尿素、偏二甲肼(C2H8N2)是氮的常见化合物,在科学技术和生产中有重要的应用。
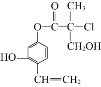
(1)肼(N2H4)是一种高能燃料,写出肼的电子式________,有关化学反应的能量变化如下图所示,已知H2O(g)=H2O(l) ΔH=-44kJ·mol-1,写出肼燃烧的燃烧热的热化学方程式为__________。
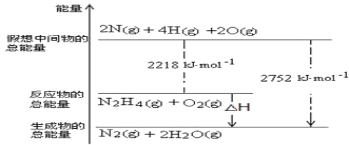
(2)火箭使用偏二甲肼(C2H8N2)作燃料,四氧化二氮(N2O4)为氧化剂,燃烧反应放出巨大能量把火箭送入太空,该反应的化学方程式为____________。
II.氨的合成是最重要的化工生产之一。
已知:N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ·mol-1
在甲、乙、丙三个不同密闭容器中,按不同方式投料,起始温度和容积相同,相关数据如下表所示:
容器 | 甲 | 乙 | 丙 |
相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
反应物投料 | 1molN2、3molH2 | 2molNH3 | 2molNH3 |
平衡时容器体积 | V甲 | V乙 | V丙 |
反应的平衡常数K | K甲 | K乙 | K丙 |
平衡时NH3的浓度/molL-1 | c甲 | c乙 | c丙 |
平衡时NH3的反应速率/molL-1min-1 | υ甲 | υ乙 | υ丙 |
则平衡时容器的体积V甲____________V丙,平衡常数K丙_________K乙(填>、<或=)
III.尿素(H2NCONH2)是一种非常重要的高氮化肥,在工农业生产中有着非常重要的地位。
(1)合成尿素的第一步反应为:2NH3(g)+CO2(g)H2NCOONH4(氨基甲酸铵)(l) △H1 ,若加入恒温、恒容容器中的NH3和CO2的物质的量之比为2:1,能说明反应达到化学平衡状态的是________
a. CO2的浓度不再变化 b. NH3的百分含量不再变化 c. 容器内气体的密度不再变化 d. 混合气体的平均相对分子质量不再变化 e. 2υ(NH3)正=υ (CO2)逆
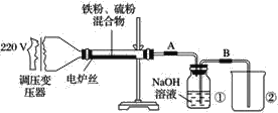
(2)尿素(NH2CONH2) 燃料电池结构如图所示。其工作时负极电极反应式可表示为:_________。