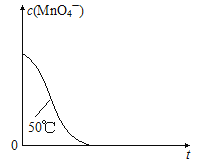题目内容
【题目】下列各组中离子在水溶液中能大量共存且满足相应要求的是( )
选项 | 离子 | 要求 |
A | K+、NO | c(K+)<c(Cl-) |
B | Na+、NO | 逐滴滴加盐酸立即有气体产生 |
C | Na+、Al3+、Mg2+、SO | 逐滴滴加氨水立即有沉淀产生 |
D | NH | 滴加NaOH浓溶液立刻有气体产生 |
A.AB.BC.CD.D
【答案】C
【解析】
A.K+、NO![]() 、Cl-、SO
、Cl-、SO![]() 离子之间不发生反应,符合电荷守恒,c(K+)=c(NO
离子之间不发生反应,符合电荷守恒,c(K+)=c(NO![]() )+ c(Cl-)+ 2c(SO
)+ c(Cl-)+ 2c(SO![]() ),c(K+)>c(Cl-),故A错误;
),c(K+)>c(Cl-),故A错误;
B.Na+、NO![]() 、CO
、CO![]() 、Cl-离子之间不发生反应,碳酸根离子中逐滴滴加盐酸过一会才有气体产生,CO
、Cl-离子之间不发生反应,碳酸根离子中逐滴滴加盐酸过一会才有气体产生,CO![]() 先与氢离子反应生成碳酸氢根离子,再滴加氢离子生成水和二氧化碳,故B错误;
先与氢离子反应生成碳酸氢根离子,再滴加氢离子生成水和二氧化碳,故B错误;
C.Na+、Al3+、Mg2+、SO![]() 离子之间不发生反应,逐滴滴加氨水,Al3+、Mg2+和氨水反应生成氢氧化铝和氢氧化镁沉淀,立即有沉淀产生,故C正确;
离子之间不发生反应,逐滴滴加氨水,Al3+、Mg2+和氨水反应生成氢氧化铝和氢氧化镁沉淀,立即有沉淀产生,故C正确;
D.NH![]() 、K+、SO
、K+、SO![]() 、H+离子之间不发生反应,滴加NaOH浓溶液会先和氢离子反应,当氢离子消耗完后再与铵根离子反应放出氨气,故D错误;
、H+离子之间不发生反应,滴加NaOH浓溶液会先和氢离子反应,当氢离子消耗完后再与铵根离子反应放出氨气,故D错误;
答案选C。

【题目】CO2是地球上取之不尽用之不竭的碳源,将CO2应用于生产中实现其综合利用是目前的研究热点。
(1)CO2加氢制备甲酸(HCOOH,熔点8.4℃沸点100.8℃)是利用化学载体进行H2储存的关键步骤。
已知:H2(g)+CO2(g)![]() HCOOH(l) △H1=-30.0kJmol-1
HCOOH(l) △H1=-30.0kJmol-1
2H2(g)+O2(g)=2H2O(1) △H2=-571.6kJmol-1
则表示HCOOH燃烧热的热化学方程式为___。
(2)在催化作用下由CO2和CH4转化为CH3COOH的反应历程示意图如图。
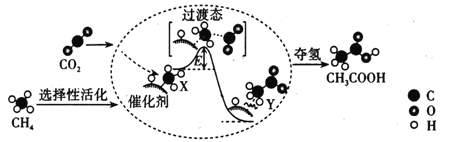
①在合成CH3COOH的反应历程中,下列有关说法正确的是___。填(字母)
a.该催化剂使反应的平衡常数增大
b.CH4→CH3COOH过程中,有C—H键发生断裂
c.由X→Y过程中放出能量并形成了C—C键
②该条件下由CO2和CH4合成CH3COOH的化学方程式为___。
(3)CO2与H2在一定条件下反应可生成甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H<0。改变温度时,该反应中的所有物质都为气态,起始温度、容积均相同(T1℃、2L密闭容器)。实验过程中的部分数据见下表:
CH3OH(g)+H2O(g) △H<0。改变温度时,该反应中的所有物质都为气态,起始温度、容积均相同(T1℃、2L密闭容器)。实验过程中的部分数据见下表:
反应时间 | n(CO2)/mol | n(H2)/mol | n(CH3OH)/mol | n(H2O)/mol | |
实验I恒温恒容 | 0min | 2 | 6 | 0 | 0 |
10min | 4.5 | ||||
20min | 1 | ||||
30min | 1 | ||||
实验II绝热恒容 | 0min | 0 | 0 | 2 | 2 |
①实验I,前10min内的平均反应速率υ(CH3OH)=___。
②平衡时CH3OH的浓度:c(实验I)___c(实验II)(填“>”、“<”或“=”,下同)。实验I中当其他条件不变时,若30min后只改变温度为T2℃,再次平衡时n(H2)=3.2mol,则T1___T2。
③已知某温度下该反应的平衡常数K=160,开始时在密闭容器中只加入CO2和H2,反应10min时测得各组分的浓度如下表,则此时υ正___υ逆。
物质 | H2 | CO2 | CH3OH | H2O |
浓度/(mol·L-1) | 0.2 | 0.2 | 0.4 | 0.4 |
【题目】某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案。
编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
浓度/mol·L-1 | 体积/mL | 浓度/mol·L-1 | 体积/mL | ||
① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
(1)写出H2C2O4溶液和酸性KMnO4溶液反应的离子方程式___________;
(2)探究温度对化学反应速率影响的实验编号是_____(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是_____;
(3)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率υ(KMnO4)=_____mol/(L·min);
(4)已知50℃时c(MnO4-)~反应时间t的变化曲线如图。若保持其他条件不变,请在坐标图中,画出25℃时c(MnO4-)~t的变化曲线示意图________。