题目内容
【题目】已知Ag2SO4的Ksp=c2(Ag+)×c(SO42-)=1.4×10-5,将适量Ag2SO4固体溶于100mL水中至刚好饱和,此时溶液中c(Ag+)=0.030mol·L-1。若t1时刻改变条件,下图中不正确的是( )
A. 加入100mL蒸馏水
加入100mL蒸馏水
B. 加入100mL0.010 mol·L-1AgSO4溶液
加入100mL0.010 mol·L-1AgSO4溶液
C. 加入100mL0.020mol·L-1Na2SO4溶液
加入100mL0.020mol·L-1Na2SO4溶液
D. 加入100mL0.040mol·L-1AgNO3溶液
加入100mL0.040mol·L-1AgNO3溶液
【答案】D
【解析】
Ag2SO4的Ksp=c2(Ag+)×c(SO42-)=1.4×10-5,溶度积常数是一个温度常数,温度不变,溶度积常数不变,而Ag+或SO42-浓度改变,平衡发生移动,以此来解答。
A.加入蒸馏水,原饱和溶液变成不饱和溶液,Ag+、SO42-浓度均下降,说法正确,A不符合题意;
B.加入低浓度的硫酸银溶液,原饱和溶液同样要变成不饱和溶液,各离子浓度均下降,说法正确,B不符合题意;
C.加入更大浓度的硫酸钠溶液,硫酸根离子浓度加大,银离子浓度减小,说法正确。C不符合题意;
D.加入更大浓度的硝酸银溶液,银离子浓度加大,根据沉淀溶度积常数不变,可知硫酸根离子浓度必然减小,图象与事实不符合,说法错误,D符合题意;
故合理选项是D。

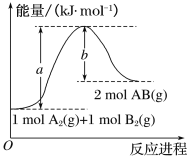
【题目】(1)实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式: ___________。
(2)由气态基态原子形成1mol化学键释放的最低能量叫键能。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。
化学键 | H-H | N-H | N≡N |
键能/kJ·mol-1 | 436 | 391 | 945 |
已知反应N2+3H2![]() 2NH3 △H=a kJ·mol-1。试根据表中所列键能数据计算a 的数值:__________。
2NH3 △H=a kJ·mol-1。试根据表中所列键能数据计算a 的数值:__________。
(3)以CO作还原剂与磷石膏反应,不同反应温度下可得到不同的产物。向盛有CaSO4的真空恒容密闭容器中充入CO,且c初始(CO)=1×10-4mol·L-1,反应体系起始总压强为0.1a MPa, 1150℃下,反应:CaSO4(s) + CO(g) ![]() CaO(s) + CO2(g) + SO2(g)达到平衡时, CO的转化率为80%,该反应的压强平衡常数Kp=________MPa(用含a的代数式表示;用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;忽略副反应)。
CaO(s) + CO2(g) + SO2(g)达到平衡时, CO的转化率为80%,该反应的压强平衡常数Kp=________MPa(用含a的代数式表示;用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;忽略副反应)。
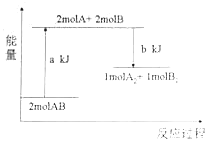
【题目】近年来,全国部分地区被雾霾笼罩,机动车尾气排放成为引发雾霾的罪魁祸首。提高空气质量,减少机动车尾气排放成为当务之急。汽车内燃机工作时引起反应:N2(g)+O2(g) ![]() 2NO(g),是导致汽车尾气中含有NO的原因之一。已知断裂某些共价键需要的能量如表:
2NO(g),是导致汽车尾气中含有NO的原因之一。已知断裂某些共价键需要的能量如表:
断裂的共价键 | O =O | N≡N | N—O |
需要的能量 | 495 kJ·mol-1 | 945 kJ·mol-1 | 630 kJ·mol-1 |
(1)机动车发动机工作时会引发N2和O2的反应,该反应是____(填“放热”或“吸热”)反应,1 molO2与1 molN2的总能量比2 molNO的总能量___(填“大”或“小”)。
(2)N2与O2合成NO的热化学方程式可以表示为![]() N2(g)+
N2(g)+![]() O2(g)=NO(g)ΔH,则ΔH=_____。
O2(g)=NO(g)ΔH,则ΔH=_____。
(3)NO与CO反应的热化学方程式可以表示为2NO(g)+2CO(g)=2CO2(g)+N2(g) ΔH=a kJ·mol-1,但该反应的速率很小,若使用机动车尾气催化转化器,尾气中的NO与CO可以转化成无害物质排出。上述反应在使用“催化转化器”后,a___(填“增大”“减小”或“不变”)。
(4)已知:①Fe(s)+![]() O2(g)=FeO(s) ΔH1=-275.0 kJ·mol-1;
O2(g)=FeO(s) ΔH1=-275.0 kJ·mol-1;
②2Al(s)+![]() O2(g)=Al2O3(s) ΔH2=-1 675.0 kJ·mol-1。
O2(g)=Al2O3(s) ΔH2=-1 675.0 kJ·mol-1。
Al和FeO发生铝热反应的热化学方程式是_______。