题目内容
4.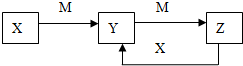 物质X、Y、Z有如图转化关系:请回答下列问题:
物质X、Y、Z有如图转化关系:请回答下列问题:(1)若X、Y、Z中均含有铝元素,则Y的化学式是Al(OH)3,实验室用明矾制取该物质的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
(2)若M是某元素的最高价氧化物且为气态,此元素的最高价与最低价化合价代数和为0,X是由电子数均为10的阴阳离子组成,则Y溶液中离子浓度大小的顺序为c(Na+)>c(CO32-)>c(OH-)>c(HCO3--)>c(H+).
(3)若X为黄绿色气体,M是常见金属.完成下列问题:
①X能与石灰乳反应制取漂白粉,其离子方程式Cl2+Ca(OH)2=Ca2++ClO-+Cl-+H2O
②含M的一种盐可以作为杀菌消毒、净水剂,其一种制备方法是:以M(OH)3、NaClO和KOH为原料,请写出此反应的离子方程式2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O
③M(OH)3溶液中存在如下的沉淀溶解平衡:M(OH)3(s)?M3+ (aq)+3OH-(aq),常温下,M(OH)3的溶度积Ksp=4.0×10-38,要使M3+离子浓度降至10-5mol•L-1,溶液的PH应调至3.2. (lg2=0.3,lg5=0.7)
分析 (1)若X、Y、Z中均含有铝元素依据铝离子和碱反应生成氢氧化铝沉淀是两性氢氧化物,溶于过量强碱溶液中生成偏铝酸盐,偏铝酸盐和二氧化碳反应生成氢氧化铝沉淀;明矾和过量氨水反应得到氢氧化铝沉淀;
(2)若M是某元素的最高价氧化物且为气态,此元素的最高价与最低价化合价代数和为0,为+4价和-4价,判断为碳元素,氧化物为CO2,X是由电子数均为10的阴阳离子组成,为NaOH,则Y溶液为Na2CO3,Z为NaHCO3;
(3)若X为黄绿色气体为Cl2,M是常见金属有变价判断为Fe,
①氯气和氢氧化钙反应生成漂白粉;
②含M的一种盐可以作为杀菌消毒、净水剂,为Na2FeO4,其一种制备方法是:以Fe(OH)3、NaClO和KOH为原料制备得到的盐为高铁酸盐;
③依据Fe3+浓度计算氢氧根离子浓度,结合离子积常数计算得到溶液氢离子浓度,计算得到溶液PH;
解答 解:(1)若X、Y、Z中均含有铝元素依据铝离子和碱反应生成氢氧化铝沉淀是两性氢氧化物,溶于过量强碱溶液中生成偏铝酸盐,偏铝酸盐和二氧化碳反应生成氢氧化铝沉淀;明矾和过量氨水反应得到氢氧化铝沉淀,反应的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,
故答案为:Al(OH)3,Al3++3NH3•H2O=Al(OH)3↓+3NH4+,
(2)若M是某元素的最高价氧化物且为气态,此元素的最高价与最低价化合价代数和为0,为+4价和-4价,判断为碳元素,氧化物为CO2,X是由电子数均为10的阴阳离子组成,为NaOH,则Y溶液为Na2CO3,Z为NaHCO3,Na2CO3溶液中碳酸根离子水解分步进行,溶液中离子浓度大小的顺序为c(Na+)>c(CO32-)>c(OH-)>c(HCO3--)>c(H+),
故答案为:c(Na+)>c(CO32-)>c(OH-)>c(HCO3--)>c(H+);
(3)①氯气与石灰乳反应制取漂白粉,其离子方程式为:Cl2+Ca(OH)2=Ca2++ClO-+Cl-+H2O,
故答案为:Cl2+Ca(OH)2=Ca2++ClO-+Cl-+H2O;
②含M的一种盐可以作为杀菌消毒、净水剂,为Na2FeO4,其一种制备方法是:以Fe(OH)3、NaClO和KOH为原料制备得到的盐为高铁酸盐,反应的离子方程式为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O,
故答案为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O;
③常温下,M(OH)3的溶度积Ksp=4.0×10-38,要使M3+离子浓度降至10-5mol•L-1,c3(OH-)=$\frac{4.0×1{0}^{-38}}{1{0}^{-5}}$=4×10-33mol/L,c(OH-)=$\root{3}{4×1{0}^{-33}}$mol/L=$\root{3}{4}$×10-11mol/L,c(H+)=$\frac{1{0}^{-14}}{c(O{H}^{-})}$=$\frac{1}{\root{3}{4}}$×10-3mol/L,溶液的PH=-lgc(H+)=$\frac{1}{3}$lg4+3=3.2,
故答案为:3.2;
点评 本题考查了物质推断,物质性质的分析应用,主要是电解质溶液中离子浓度大小比较,溶度积计算分析,离子方程式书写,掌握基础是关键,题目难度中等.

 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案| A. | 元素的相对原子质量的递增 | |
| B. | 元素的原子半径呈周期性变化 | |
| C. | 元素原子的最外层电子排布呈周期性变化 | |
| D. | 元素的金属性和非金属性呈周期性变化 |
| A. | 以二甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池中负极上的电极反应式为:CH3OCH3-12e-+12OH-═2CO2+8H2O | |
| B. | 二甲醚为不可再生能源 | |
| C. | 二甲醚分子中只含有极性键 | |
| D. | 二甲醚燃烧的热化学方程式表示为:CH3OCH3(g)+3O2(g)═2CO2(g)+3H2O(g);△H=-1455kJ/mol |
| A. | H2O2和酸性氯化亚铁溶液反应:2Fe2++H2O2+2 H+═2Fe3++2H2O | |
| B. | 碳酸氢镁溶液中加入过量石灰水:Mg2++2HCO3-+2Ca2++4OH-═2CaCO3↓+Mg(OH)2↓+2H2O | |
| C. | 3 mol的Cl2通入含2 mol FeI2的溶液中:2Fe2++4I-+3Cl2═2Fe3++6Cl-+2I2 | |
| D. | 将SO2通入Ca(ClO)2溶液中:Ca2++2ClO-+SO2+H2O═CaSO3+2HClO |
| A. | 再滴加AgNO3溶液,观察是否有AgI沉淀产生 | |
| B. | 加入CCl4振荡后,观察下层液体颜色 | |
| C. | 再滴加AgNO3溶液,观察是否有AgCl沉淀产生 | |
| D. | 再滴加KSCN溶液,观察是否有血红色 |
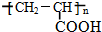 、GCH3CH(OH)CH2OH;
、GCH3CH(OH)CH2OH;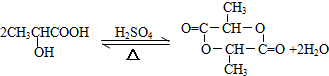 ;②F→A
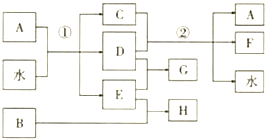
;②F→A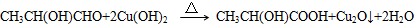 .
.
 ;
;