题目内容
18.已知工业上在500℃时,利用CO和CO2生产甲醇的热化学方程式分别是:2H2(g)+CO(g)?CH3OH(g)△H=-90.1kJ/mol
3H2(g)+CO2(g)?CH3OH(g)+H2O (g)△H=-49.0kJ/mol
(1)反应H2(g)+CO2(g)?H2O(g)+CO(g)△H=+41.1 kJ/mol.
(2)若500℃时反应H2(g)+CO2(g)?H2O(g)+CO(g)的平衡常数K=1.0.该条件下,在1L密闭容器中,当加入等物质的量的H2和 CO2进行反应时,c(CO)与反应时间t的变化曲线X如图1所示.

①当反应进行到t1时刻,容器内c(CO2)=4mol/L.
②当容器内c(CO2)=5mol•L-1时,该反应v正>v逆(填“>、<或=”).
③当反应进行到t2时刻,若使反应按曲线Y进行,调控反应条件的方法是升高温度.
(3)微生物可使甲醇在酸性环境下与空气中氧气发生原电池反应,反应原理如图2所示.
①反应中阳离子的运动方向是A到B.
②B极的反应式是O2+4e-+4H+=2H2O.
③A极可能产生的物质是cd.
a.H2 b.CH4c.HCOOH d.CO2.
分析 (1)2H2(g)+CO(g)?CH3OH(g)△H=-90.1kJ/mol ①
3H2(g)+CO2(g)?CH3OH(g)+H2O (g)△H=-49.0kJ/mol ②,利用②-①即可得出;
(2)①依据平衡常数K=1.0,利用三段法计算即可;
②依据①的计算判断此时浓度下,平衡移动方向;
③由X变到Y即增加CO的浓度,依据反应特点判断即可;
(3)①甲醇原电池中甲醇在负极放电,据此判断阳离子的移动方向;
②正极氧气放电,在酸性环境中生成水,据此书写即可;
③A电极为负极,失去电子,发生氧化反应,化合价升高,据此判断即可.
解答 解:(1)(1)2H2(g)+CO(g)?CH3OH(g)△H=-90.1kJ/mol ①,3H2(g)+CO2(g)?CH3OH(g)+H2O (g)△H=-49.0kJ/mol ②,②-①得:H2(g)+CO2(g)?H2O(g)+CO(g)△H=-49.0kJ/mol-(-90.1kJ/mol)=+41.1 kJ/mol,故答案为:+41.1 kJ/mol;
(2)①由图可知:t1时刻,根据图可靠在,平衡时容器内c(CO)=3mol/L,即转化生成的CO为3mol,那么有
H2(g)+CO2(g)?H2O(g)+CO(g)
始(mol/L)x x 0 0
转 3 3 3 3
平 x-3 x-3 3 3
K=$\frac{3×3}{(x-3)•(x-3)}$=1,解x=6,6mol/L-2mol/L=4mol/L,故答案为:4mol/L;
②由(1)计算可知t1时刻,容器内c(CO2)=2mol/L,此时仍未达到平衡,即v正>v逆,故当容器内c(CO2)=5mol•L-1时,该反应v正>v逆,故答案为:>;
③由(1)计算得知,反应H2(g)+CO2(g)?H2O(g)+CO(g)△H=+41.1kJ/mol,即为吸热反应,要使得反应按曲线Y进行,即升高温度即可,故答案为:升高温度;
(3)①甲醇原电池中甲醇在负极放电,即A为原电池的负极,溶液中阳离子由A移到B,故答案为:A至B;
②氧气在正极放电,结合酸性溶液中的氢离子生成水,电极反应方程式为:O2+4e-+4H+=2H2O,故答案为:O2+4e-+4H+=2H2O;
③甲醇中C元素的化合价为-2价,失去电子发生氧化反应,化合价升高,可以生成HCOOH(C的化合价为+2价),可以生成CO2(C的化合价为+4价),故选cd.
点评 本题主要考查的是盖斯定律的应用、化学平衡的有关计算以及化学平衡常数的计算、原电池原理等,综合性较强,有一定的难度,为常考题.

| A. | 0.2molAl与足量NaOH溶液反应,生成的H2分子数为0.3NA | |
| B. | 常温下,1LpH=1的盐酸溶液,由水电离的H+离子数目为0.1NA | |
| C. | 铅蓄电池中,当正极增加9.6g时,电路中通过的电子数目为0.2NA | |
| D. | 11P4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4 反应中,6 mol CuSO4能氧化白磷的分子数为1.1NA |
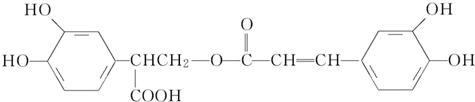 ,
,以邻苯二酚为原料合成迷迭香酸的路线为
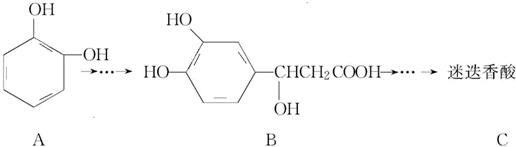
下列说法正确的是( )
| A. | 有机物B可以发生取代、加成、消去、氧化反应 | |
| B. | 有机物A分子中所有原子一定在同一平面上 | |
| C. | 有机物C在浓硫酸催化下水解的一种产物是B | |
| D. | 1 mol B与足量的NaOH溶液反应,最多可消耗4 mol NaOH |
| A. | 可用铁作阳极材料 | |
| B. | 电解过程中阳极附近溶液的pH升高 | |
| C. | 阳极反应方程式为:2Cl--2e-═Cl2↑ | |
| D. | 1 mol二价镍全部转化为三价镍时,外电路中通过 了2 mol 电子 |
| A. | X2YZ3 | B. | X2YZ4 | C. | X3YZ4 | D. | X4Y2Y7 |
| ① | ② | ③ | 实验结论 |  | |
| A | 硫酸 | 碳酸钠 | 硅酸钠溶液 | 非金属性:S>C>Si | |
| B | 硝酸 | 碳酸钠 | 苯酚钠溶液 | 酸性:硝酸>碳酸>苯酚 | |
| C | 盐酸 | 二氧化锰 | 溴化钾溶液 | 氧化性:二氧化锰>氯气>液溴 | |
| D | 溴的苯溶液 | 铁屑 | 硝酸银溶液 | 苯和溴单质在铁的催化剂作用下发生取代反应 |
| A. | A | B. | B | C. | C | D. | D |
①核内质子数
②核外电子数
③最外层电子数
④核外电子层数.
| A. | ①②③ | B. | ①②④ | C. | ①③④ | D. | ②③④ |
| A. | 新型材料聚酯纤维、光导纤维都属于有机高分子材料 | |
| B. | “地沟油”不能食用,但经加工处理后,可用来制造肥皂和生物柴油 | |
| C. | 糖类、油脂、蛋白质等都具有固定的熔沸点 | |
| D. | 可用热的饱和碳酸钠溶液除去金属表面的矿物油(如机油、润滑油等) |
