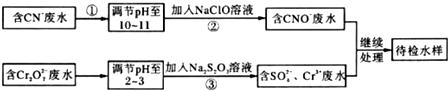
题目内容
8.某合作学习小组的同学拟用硼砂制取硼酸并测定硼酸样品的纯度.制备硼酸的实验流程如下: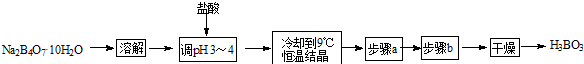
(1)溶解硼砂时需要的玻璃仪器有:烧杯和玻璃棒.
(2)用pH试纸测定溶液pH的操作方法为用干燥洁净的玻璃棒蘸取待测溶液点在试纸中央,半分钟内与标准比色卡进行对照,判断溶液的pH.
(3)用盐酸酸化硼砂溶液生成硼酸的离子方程式为B4O72-+2H++5H2O=4H3BO3.
(4)实验流程中缺少的步骤a、步骤b操作分别为过滤、洗涤.
(5)硼酸酸性太弱不能用碱的标准溶液直接滴定,实验室常采用间接滴定法,其原理为:

滴定步骤为:

①滴定到终点时溶液颜色变化是由无色变为浅红色.
②若滴定到终点时消耗NaOH标准溶液22.00mL,则本次滴定测得的硼酸样品中硼酸的质量分数为90.93%(假定杂质不反应).
③若滴定时滴定管尖嘴部分有气泡,滴定过程中消失,将导致测得的结果偏大.(选填:“偏大”、“偏小”或“不变”).
分析 用硼砂制取硼酸并测定硼酸样品的纯度,硼砂溶解后加入盐酸调节溶液PH为3-4,冷却到9°C,恒温结晶,过滤洗涤干燥得到硼酸,
(1)固体溶解需要烧杯和玻璃棒;
(2)pH试纸测定溶液pH的操作方法是用干燥洁净的玻璃棒蘸取待测溶液点在试纸中央,半分钟内与标准比色卡进行对照得到溶液PH;
(3)用盐酸酸化硼砂溶液生成硼酸反应为:B4O72-+2H++5H2O=4H3BO3;
(4)依据上述分析可知操作步骤是过滤洗涤;
(5)①滴定过程中加入的指示剂是酚酞溶液,滴入氢氧化钠溶液到反应终点,溶液颜色由无色变化为浅红色证明反应达到终点;
②分析滴定原理和反应的定量关系计算;
③若滴定时滴定管尖嘴部分有气泡,滴定过程中消失,则消耗标准溶液体积增大,依据c(待测)=$\frac{c(标准)V(标准)}{V(待测)}$,测定结果偏大.
解答 解:用硼砂制取硼酸并测定硼酸样品的纯度,硼砂溶解后加入盐酸调节溶液PH为3-4,冷却到9°C,恒温结晶,过滤洗涤干燥得到硼酸;
(1)固体溶解需要烧杯和玻璃棒,溶解硼砂时需要的玻璃仪器有:烧杯和玻璃棒;
故答案为:玻璃棒;
(2)pH试纸测定溶液pH的操作方法是用干燥洁净的玻璃棒蘸取待测溶液点在试纸中央,半分钟内与标准比色卡进行对照得到溶液PH,用干燥洁净的玻璃棒蘸取待测溶液点在试纸中央,半分钟内与标准比色卡进行对照,判断溶液的pH;
故答案为:用干燥洁净的玻璃棒蘸取待测溶液点在试纸中央,半分钟内与标准比色卡进行对照,判断溶液的pH;
(3)硼砂中弱酸阴离子结合氢离子在溶液中生成硼酸,用盐酸酸化硼砂溶液生成硼酸反应的离子方程式为:B4O72-+2H++5H2O=4H3BO3;
故答案为:B4O72-+2H++5H2O=4H3BO3;
(4)依据上述分析可知实验流程中缺少的步骤a、步骤b操作分别为过滤、洗涤;
故答案为:过滤、洗涤;
(5)①分析流程可知,滴定过程中加入的指示剂是酚酞溶液,滴入氢氧化钠溶液到反应终点的现象为,滴入最后一滴溶液颜色由无色变化为浅红色且半分钟不变化,证明反应达到终点,滴定到终点时溶液颜色变化是由无色变为浅红色;
故答案为:由无色变为浅红色;
②分析滴定原理和反应的定量关系计算,实验室常采用间接滴定法,其原理为: ,
,
若滴定到终点时消耗NaOH标准溶液22.00mL,氢氧化钠溶液浓度为0.2000mol/L,
H3BO3~NaOH
1 1
n 0.0220L×0.2000mol/L
n=0.0044mol
则本次滴定测得的硼酸样品中硼酸的质量分数=$\frac{0.0044mol×62g/mol}{0.3000g}$×100%=90.93%;
故答案为:90.93%;
③若滴定时滴定管尖嘴部分有气泡,滴定过程中消失,则消耗标准溶液体积增大,测定结果偏大;
故答案为:偏大.
点评 本题考查了物质制备的流程分析判断,物质性质和实验过程判断,滴定实验的操作过程和计算应用,掌握基础是关键,题目难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | E(4s)>E(3p)>E(3d) | B. | E(3s)>E(3p)>E(3d) | C. | E(6s)>E(4f)>E(5d) | D. | E(5s)>E(4p)>E(3d) |
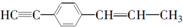 的说法中正确的是( )
的说法中正确的是( )| A. | 有7个碳原子可能在同一直线上 | |
| B. | 只可能有5个碳原子在同一直线上 | |
| C. | 最多只可能有9个碳原子在同一平面上 | |
| D. | 所有原子都可能在同一平面上 |
| A. | NaOH | B. | NH3•H2O | C. | CuO | D. | BaCl2 |
| A. | 元素A、B只能形成一种化合物 | |
| B. | 一定条件下,元素C、D的最高价氧化物对应的水化物之间不能发生反应 | |
| C. | 工业上常用电解法制备元素C、D的单质 | |
| D. | 化合物AE与CE含有相同类型的化学键 |
| A. | 甲烷的球棍模型为 | B. | 乙醇的分子式为C2H3CH2OH | ||
| C. | 邻甲基苯酚的结构简式为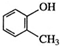 | D. | 聚乙烯的结构简式为CH2=CH2 |
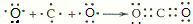 ;用电子式表示C、D两元素形成化学键的过程
;用电子式表示C、D两元素形成化学键的过程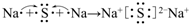 .
.